LUYOR-3109高強度紫外催化光源促銷
LUYOR-3109紫外光源采用了9顆365nm大功率led,安裝有二次光學透鏡,輸出紫外線強度高,...
2024-08-08作者:時間:2019-11-23 20:42:26瀏覽3231 次
外源基因導入宿主細胞后有兩種表達模式, 一是整合到宿主細胞基因組中穩定表達; 二是以質粒形式導入宿主細胞后瞬時表達。由于后者快速且方便已被廣泛應用到基因工程中)。植物瞬時表達系統不會產生基因沉默、基因漂移等, 可有效避免基因污染, 是檢測外源基因表達情況的理想方法。棉花外源基因的穩定表達是個復雜的長期過程,建立一個快速、經濟、安全的瞬時表達系統對研究棉花基因功能有重要意義。
植物瞬時表達系統在研究功能基因的亞細胞定位、蛋白質互作、啟動子活性等方面具有重要作用。選取棉花(Gossypium hirsutum)子葉為材料, 以β-葡糖醛酸酶基因(GUS)、增強型綠色熒光蛋白基因(eGFP)為報告基因, 對棉花子葉生長時間、農桿菌濃度、注射量、共培養時間等因素進行了分析, 建立了農桿菌介導的棉花子葉瞬時表達系統。結果表明,對萌發6天的棉花子葉注射50 μLOD600為0.5的含目的基因的農桿菌LBA4404或GV3101, 共培養2–3天后, 外源基因表達效率更高。利用此方法從棉花萌發到觀測結果, 僅需8–13天, 且操作簡單易行, 可快速檢測棉花來源的啟動子活性、亞細胞定位、蛋白質互作等。該方法在棉花基因功能研究方面有很好的應用價值。
棉花(Gossypium hirsutum)是世界紡織業的主要原材料, 有很高的經濟價值和應用價值。近年來, 棉花的基因組測序已經完成, 其中有44.9 Mb的基因已被注釋(Paterson et al., 2012)。隨著注釋基因的不斷增多, 需要尋找一種快速有效的方法對基因功能進行分析。使用瞬時表達系統操作簡單, 無需特殊儀器設備, 外源基因的表達效率高且安全, 不易產生基因漂移(邱初等, 2009; Grefen et al., 2010; 藍嵐等,2013)。同時此方法可有效避免基因沉默等, 在基因功能分析及亞細胞定位方面應用廣泛(Grebenok etal., 1997; Li et al., 2011)。
目前, 農桿菌介導的植物瞬時表達系統已在許多植物中建立并應用, 如大豆(Glycine max)、擬南芥(Arabidopsis thaliana)(Koroleva et al., 2005)、紅花(Flos carthami)(Belide et al., 2011; 楊晶等, 2011)、油菜(Brassica campestris)(譚小力等, 2012)以及玉米(Zea mays)、水稻(Oryza sativa)等(李浩戈等,2012)。近年來, 棉花中瞬時表達系統主要利用愈傷組織經酶解處理后形成的原生質體來完成。該方法能快速檢測棉花功能基因的瞬時表達、亞細胞定位等,但操作繁瑣, 需要基因槍進行外源基因的轉化, 實驗成本高(李杰等, 2003; Shibasaki et al., 2012)。本實驗以棉花子葉為材料, 利用農桿菌注射法建立了瞬時表達系統, 確定了子葉的更佳生長時期、注射菌量以及共培養時間等。在此基礎上, 構建了35S-eGFP(pG3)表達載體, 對棉花子葉進行了轉化。實驗結果表明, 該方法不僅適用于帶GUS標簽的基因, 也適合帶eGFP標簽的基因功能研究。上述方法的建立有助于棉花功能基因的亞細胞定位、蛋白質互作以及啟動子活性等研究。
1 材料與方法
1.1 實驗材料
棉種柯字312(Gossypium hirsutum cv. ‘Coker 312’)系河北農業大學馬峙英教授饋贈。pGEM-T Easy載體購自Promega 公司。農桿菌(Agrobacterium tumefacien)LBA4404菌株由北京大學朱玉賢教授惠贈。含pCAMBIA2301的GV3101菌種由江蘇大學生命科學學院譚小力教授惠贈。含eGFP的pUCegfpC質粒為西北農林科技大學王倩老師惠贈。農桿菌GV3101菌株、大腸桿菌(Escherichia coli)DH5α菌株為本實驗室保存。
1.2 實驗方法
1.2.1 植物培養
選取飽滿的種子, 在37°C水浴中浸泡14小時, 播種于盛有培養土(蛭石:營養土=1:3, v/v)的小缽中, 覆膜后于28°C、光暗周期為16小時/8小時的室內培養。待發芽后去膜, 生長數天后用于實驗。
1.2.2 子葉注射及共培養
吸取200 μL含pCAMBIA2301的GV3101菌液添至10mL含50 mg·L–1卡那霉素(Kan)、50 mg·L–1利福平(Rif)和20 mg·L–1慶大霉素(Gent)的LB液體培養基中,于28°C、每分鐘180轉振蕩培養至所需OD600值時,10 000 ×g離心1分鐘。收菌, 除去上清, 用含100μmol·L–1乙酰丁香酮與10 mmol·L–1硫酸鎂的MS侵染液懸浮菌體, 得到轉化液。挑選生長狀態良好且生長一致的棉花子葉, 用蒸餾水清潔葉片背面, 蘸75%乙醇擦拭, 再用蒸餾水清洗殘留乙醇。選用背面葉脈部位, 用去掉針頭的注射器注射轉化液, 注射完畢后用蘸有蒸餾水的棉簽清潔葉片背面。將注射后的棉株放入25°C、光暗周期為16小時/8小時的培養箱中培養。
1.2.3 GUS染色及活性檢測
將共培養一定天數的子葉用蒸餾水清洗后置于GUS染色液中( 每100 mLGUS 染液中含有2.1 mmolNaH2PO4, 2.9 mmol Na2HPO4, 0.5 mmol EDTA,pH7.0; 0.1 mmol KFe(CN)4, 0.1 mmol KFe(CN)3,0.1 mLTritonX-100, 0.1 g X-Gluc), 于37°C每分鐘180轉振蕩染色24小時, 然后置于真空泵中, 0.08MPa抽真空30分鐘, 繼續振蕩染色48分鐘, 除去染色液。將子葉置于無水乙醇中脫色8小時, 觀察并拍照。
用MUG法(Viana et al., 2011)提取不同處理后且共培養一定天數的棉花子葉總蛋白。吸取上清100μL, 加入到400 μL經37°C預熱的GUS提取緩沖液(每100 mLGUS提取緩沖液中含有50 mL 0.1 mol·L–1 pH7.0的磷酸緩沖液, 1 mL 10% SDS, 2 mL 0.5 mol·L–1pH 8.0的EDTA, 100 μLTriton X-100, 100 μLβ-巰基乙醇), 再加入500 μL MUG底物(8.8 mg MUG, 溶于10 mLGUS酶提取液中), 37°C溫浴。立即取出200 μL加入到800 μL反應終止液(0.2 mol·L–1Na2CO3)中混勻, 此標記為1號管, 在室溫下避光保存。此為反應0時的樣品, 熒光測定時以此為空白, 并開始計時。將反應管放入37°C水浴中進行酶反應, 60分鐘后, 取200 μL反應液, 加入到800 μL反應終止液中混勻, 此標記為2號管, 為反應60分鐘時的樣品。用多功能微孔測量儀(美國EnSpire)在激發波長365 nm、發射波長455 nm、狹縫10 nm時測定不同時間點的熒光強度值。根據4-甲基傘形酮(4-MU)制作的標準曲線得出GUS活性(Y=(C2號管–C1號管)/C總蛋白/時間(h))。
1.2.4 35S-eGFP融合表達載體的構建
以pUCegfpC質粒為模板, 上、下游引物分別為eGFP1_F(5′-TCTGAATTCATGGTGAGCAAGGGCGAG-3′)和eGFP2_R(5′-TTCTCTAGATTACTTGTACAGCTCGTCC-3′) 。用高保真酶PrimeSTAR(Ta-
KaRa)擴增獲得eGFP基因序列(5′端和3′端分別含EcoRI和XbaI酶切位點), 連入pGEM-T Easy載體。測序驗證后將該質粒命名為pG1 。將質粒pG1 與pKannibal分別用EcoRI/XbaI酶切, 回收相應片段連接并測序后得到pG2質粒。將pG2用NotI酶切, 回收35S-eGFP片段, 連接到pART27載體中, 轉化大腸桿菌DH5α, 經藍白斑篩選獲得陽性克隆, 測序正確后命名為pG3。采用凍融法將pG3轉入農桿菌LBA-4404和GV3101中, 并分別命名為LBA-pG3和GVpG3。
1.2.5 農桿菌轉化及eGFP熒光檢測
將農桿菌LBA-pG3和GV-pG3培養至OD600為0.5, 收集3 mL菌液加入900 mL MS培養基和100 mL乙酰丁香酮懸浮后使用。挑選生長6天的棉花幼苗, 在其子葉背面注射含LBA-pG3或GV-pG3的農桿菌轉化液。棉花子葉共培養1–11天后, 采集葉片, 置于倒置熒光顯微鏡(萊卡DMIL LED)下, 在490 nm藍色激發光下觀察eGFP的表達。
1.2.6 半定量PCR檢測
采集共培養3天的棉花子葉, 用打孔器在注射位置取材, 保證材料直徑均為1.3 cm。用試劑盒(Plant RNAKit, OMEGA Bio-tek)提取總RNA。取1 μg RNA用逆轉錄試劑盒(Prime ScriptTM RT Reagent Kit PerfectReal Time)逆轉成cDNA。以cDNA為模板, 棉花Actin為內參基因( 上、下游引物分別為Actin_F, 5′-AGCTATGAGTTGCCTGATGG-3′; Actin_R, 5′-ATTGTAAGTGGTCTCGTGAATA-3′), 以eGFP_F(5′-AGAACGGCATCAAGGTGAAC-3′) 和eGFP_R1(5′-TGCTCAGGTAGTGGTTGTCG-3′)分別作為上、下游引物進行PCR擴增。PCR反應體系(總體積為25μL): 12.5 μL 2×Taq PCR Mix, 1 μL cDNA, 上、下游引物(10 μmol·L–1)各2 μL, 7.5 μLddH2O。PCR反應程序為: 95°C預變性5分鐘; 95°C變性1分鐘, 60°C復性1分鐘, 72°C延伸1.5分鐘, 30個循環; 72°C終延伸10分鐘。反應產物于4°C保存。
1.2.7 免疫組織化學檢測eGFP蛋白
采集共培養3天的棉花子葉, 用打孔器取直徑為1.3cm的組織圓片, 經甲醇脫色、崩潰酶(Sigma)裂解細胞壁以及0.08 MPa抽真空30分鐘, 增加葉片滲透性后, 加入eGFP抗體, 37°C孵育3小時, 漂洗后加入顯色劑DAB, 30分鐘后用蒸餾水洗滌以停止反應。具體步驟參見文獻(Sauer et al., 2006)所述。
2 結果與討論
2.1 棉花子葉瞬時表達系統的建立
不同生長時期的子葉對農桿菌的侵染和外源基因的表達有重要的影響。本實驗采用萌發后生長2、6、10、14 和18 天的子葉為材料, 用含pCAMBIA2301 的GV3101菌液(50 μL農桿菌, OD600=0.5)(簡稱含GUS基因的農桿菌)注射棉花子葉的背面葉脈部位, 共培養2天后, 取整片子葉進行GUS染色。結果(圖1A)顯示, 隨著子葉生長期的延長, GUS染色逐步明顯, 至
第6天達到高峰, 之后GUS染色呈現降低趨勢, 至18天時幾乎不顯色。其中, 注射部位及其周圍(0.2–1.0cm)為GUS顯色部位。同步采集注射后共培養2天的子葉, 用MUG法定量分析GUS酶活性, 結果與上述定性分析結果具一致性(圖1B)。實驗表明生長6天的子葉最適合轉化。
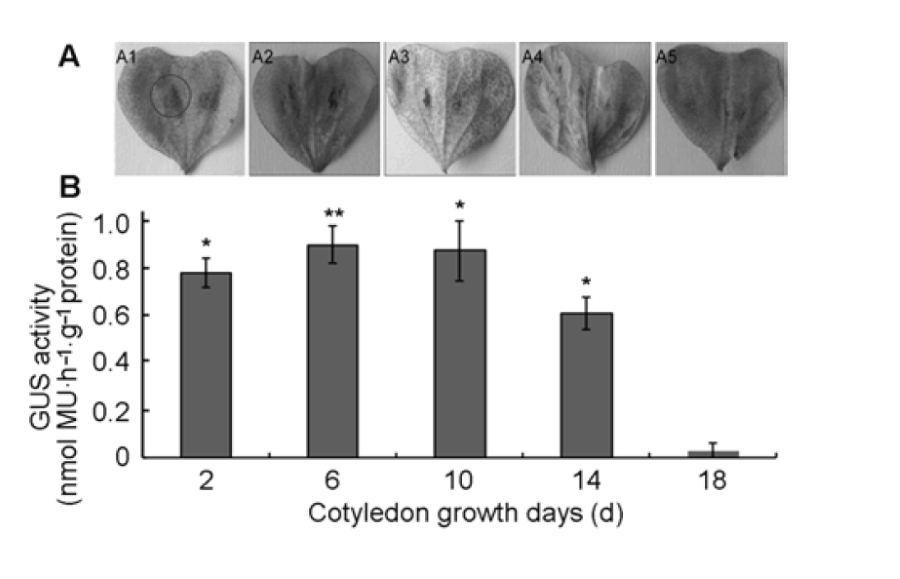
不同生長天數的棉花子葉GUS染色結果(A)及定量分析結果(B)
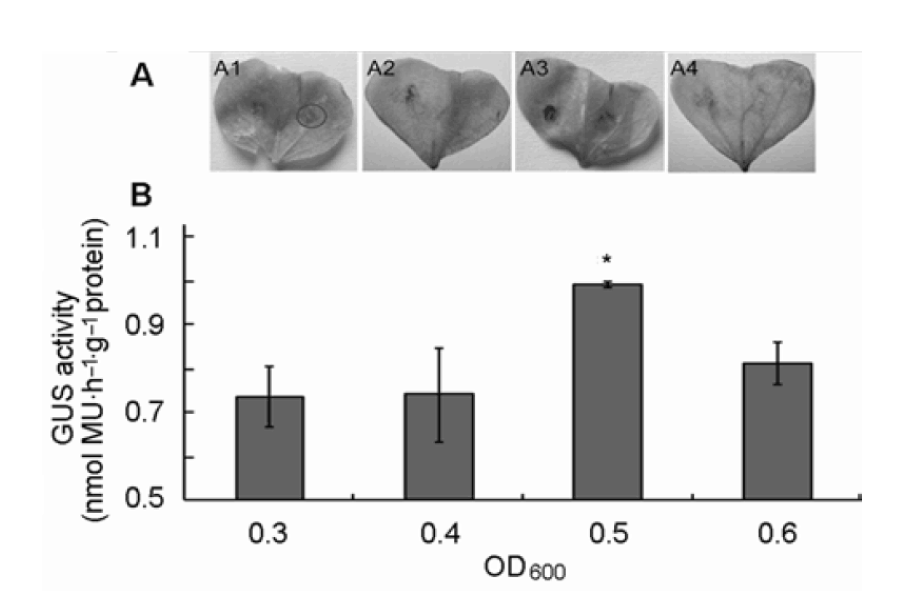
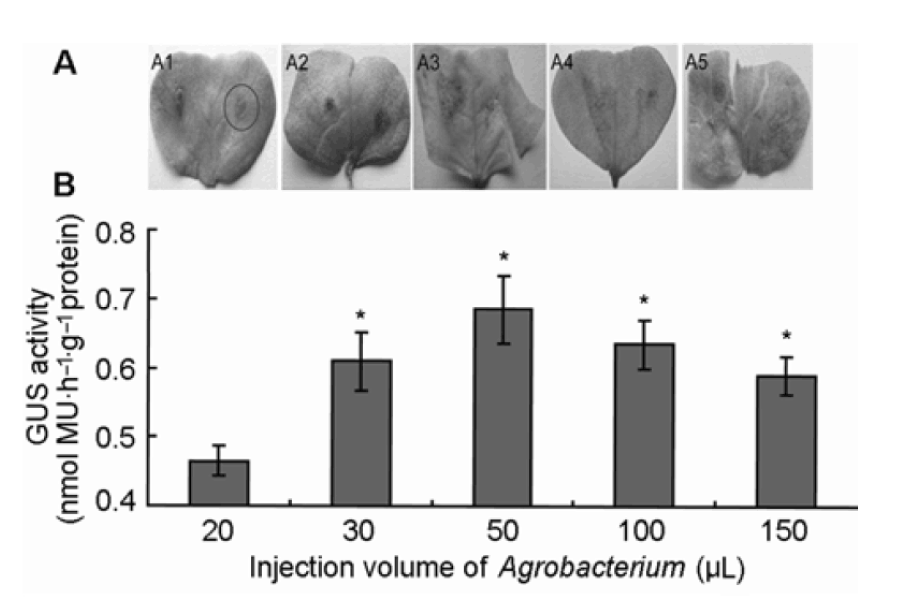
有文獻報道農桿菌濃度對葉片侵染的結果有直接影響(張福麗等, 2012)。本實驗選取OD600為0.3、0.4、0.5和0.6的含GUS基因的農桿菌50 μL分別對萌發后生長6天的子葉進行注射, 共培養2天后, 進行GUS染色(具體操作同上)。結果(圖2A)顯示, 隨著注射菌液濃度的增加, GUS染色的色斑、變得明顯, 至注射濃度OD600為0.5時達到更佳狀態, 之后GUS染色呈現下降趨勢。同步采集注射后共培養2天的子葉,提取總蛋白, 定量分析其中GUS蛋白含量, 結果與上述定性分析結果一致(圖2B)。實驗表明注射濃度OD600為0.5時染色最明顯, 此時的轉化效率更高。為了確定菌液更佳注射量, 用OD600為0.5的含GUS基因的農桿菌注射液, 對培養6天的棉花子葉進行注射, 注射量分別為20、30、50、100和150 μL。共培養2天后, 進行GUS染色(具體操作同上)。結果(圖3A)顯示, 隨著注射量的逐步增加, 子葉的顯色部位有明顯變化, 至注射量為50 μL時染色效果更好,注射量為100和150 μL時GUS染色效果下降。同步采集注射后共培養2天的子葉, 定量分析其中的GUS蛋白含量, 結果與上述定性分析結果一致(圖3B)。實驗表明OD600為0.5的農桿菌注射量為50 μL染色效果更好, 此時的轉化效率更高。
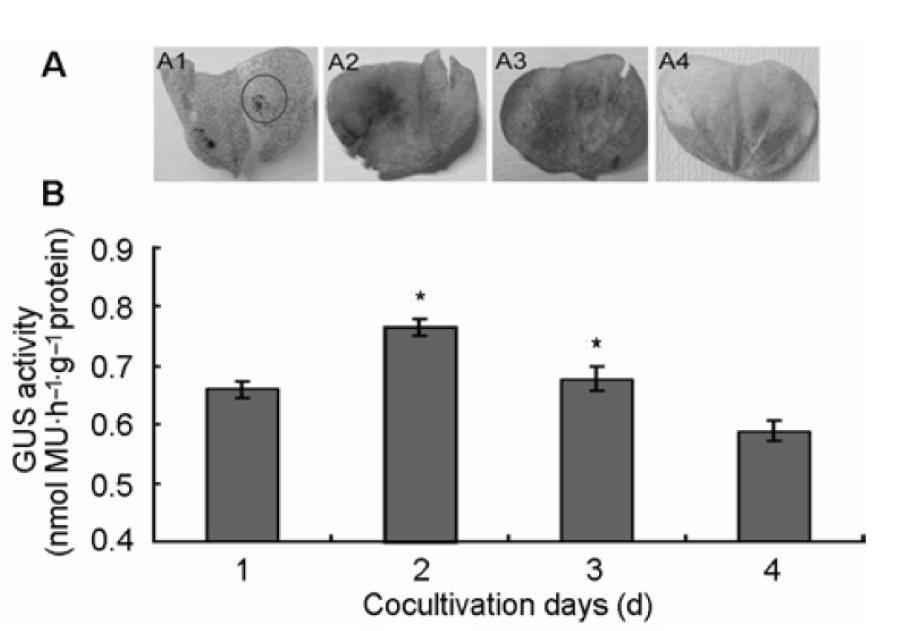
本實驗還探討了不同共培養時間對侵染結果的影響。用50 μLOD600為0.5含GUS基因的農桿菌注射液對培養6天的子葉進行注射, 分別共培養1、2、3和4天后, 進行GUS染色(具體操作同上)。結果(圖4A)顯示, 隨著共培養時間的延長, GUS染色逐漸明顯。其中在共培養2天時, GUS染色效果更好, 隨后染色效果降低。同步采集注射后共培養2天的子葉, 定量分析其中的GUS蛋白含量, 結果與上述定性分析結果一致(圖4B)。實驗表明共培養2天GUS染色效果更好, 此時的轉化效率更高。
2.2 棉花子葉瞬時表達eGFP的熒光檢測
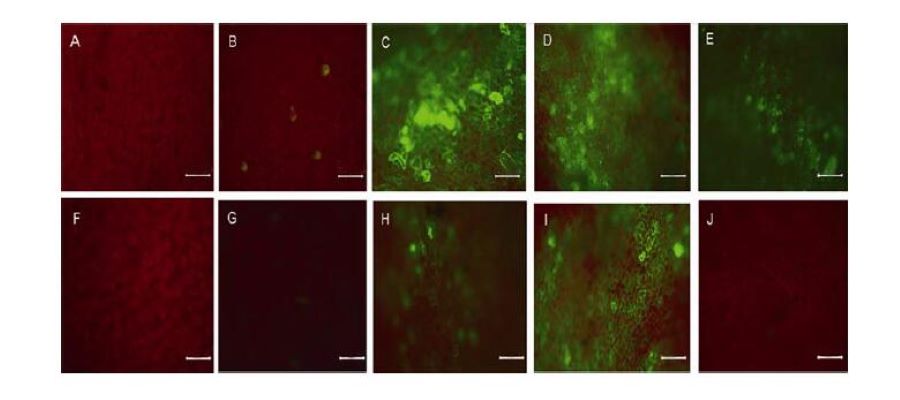
采集注射農桿菌LBA-pG3和GV-pG3后共培養1–11天的棉花子葉, 置于倒置熒光顯微鏡下觀察綠色熒光蛋白的表達。結果(圖5)顯示, 隨著共培養時間的延長,綠色熒光強度呈逐漸增強的趨勢, 至3–5天后熒光強度下降。其中注射LBA-pG3的處理組中, 在共培2天時有微量表達, 至3天時觀察到的綠色熒光強度最強, 且顯著優于同期注射GV-pG3的處理組。實驗結果表明eGFP的表達在3天時效果更佳, 且棉花子葉瞬時表達系統選擇注射農桿菌LBA4404介導的外源基因表達效果比GV3101更好。
2.3 棉花子葉瞬時表達eGFP的定量分析
為了進一步確定上述實驗中所觀察到的綠色熒光是eGFP表達的結果, 本實驗選取注射后共培養3天的子葉用半定量PCR法進行RNA水平的檢測及免疫組化分析。以cDNA為模板, Actin基因為內參, 對eGFP基因表達進行半定量PCR檢測(圖6A)。以質粒為陽性對照, 注射不含目的基因的空載農桿菌LBA4404為陰性對照, 結果顯示, 在cDNA模板量相同的條件下,陰性對照中擴增不到目的條帶, 而注射LBA-pG3能擴增出eGFP條帶。表明注射農桿菌LBA4404介導的eGFP能在棉花子葉中表達, 且在共培養3天時表達效果較好。為了進一步確定eGFP蛋白的表達情況,
本實驗還進行了棉花葉片免疫組織化學檢測, 以顯示eGFP蛋白的位置及含量。取共培養3天的棉花子葉,經處理增加葉片滲透性后, 加入eGFP抗體孵育, 用SABC染色試劑盒進行檢測, 結果如圖6B–D所示。圖6中深色圓點為細胞核, 小圓點及染色部分為表達的eGFP蛋白。與對照組(圖6B)相比, 生長6天的棉花子葉注射50 μLOD600為0.5的LBA-pG3后, 培養3天, 確有eGFP蛋白的表達。其中, 農桿菌注射部位1.3 cm區域內的eGFP蛋白的表達量(圖6D)大于注射部位1.3 cm區域外eGFP蛋白的表達量(圖6C)。上述結果表明棉花瞬時轉化系統可以成功表達外源基因。
2.4 討論
外源基因導入宿主細胞后有兩種表達模式, 一是整合到宿主細胞基因組中穩定表達; 二是以質粒形式導入宿主細胞后瞬時表達。由于后者快速且方便已被廣泛應用到基因工程中(Shibasaki et al., 2012)。植物瞬時表達系統不會產生基因沉默、基因漂移等, 可有效避免基因污染, 是檢測外源基因表達情況的理想方法。棉花外源基因的穩定表達是個復雜的長期過程(Chakravarthyet al., 2014 ), 建立一個快速、經濟、安全的瞬時表達系統對研究棉花基因功能有重要意義。
劉雪梅, 王蕾, 文添龍, 何鵬, 俞嘉寧 (2014). 農桿菌介導的棉花子葉瞬時表達系統的建立. 植物學報 49, 587–594.