LUYOR-3109高強度紫外催化光源促銷
LUYOR-3109紫外光源采用了9顆365nm大功率led,安裝有二次光學透鏡,輸出紫外線強度高,...
2024-08-08作者:生命科學事業部時間:2019-12-07 14:44:42瀏覽2906 次
轉染通常是指將核酸輸送到真核細胞,或者更明確地說是輸送到動物細胞內。術語轉染一般用來表示原核生物感染病毒或噬菌體中病毒核酸的攝取,導致成熟病毒顆粒的感染和生成。但該術語現在的含義包括將外源性核酸人工導入細胞內。
什么是轉染?
從廣義上講,轉染是采用除病毒感染外的其他方法將核酸(DNA或RNA)人工導入細胞的過程。采用各種化學、生物學或物理方法導入外源性核酸會改變細胞的特性,從而實現細胞基因功能和蛋白質表達研究。轉染后,導入的核酸可以瞬時性地存在于細胞內,只表達一段時間且不會復制,也可以穩定地整合至受體基因組內,隨著宿主基因組的復制而復制,各種基因輸送系統采用的術語與該領域的技術進展步調一致,并進一步區分不同的方法和細胞類型。
轉染
轉染通常是指將核酸輸送到真核細胞,或者更明確地說是輸送到動物細胞內。術語轉染一般用來表示原核生物感染病毒或噬菌體中病毒核酸的攝取,導致成熟病毒顆粒的感染和生成。但該術語現在的含義包括將外源性核酸人工導入細胞內。
轉化
轉化通常用來描述細菌、非動物真核細胞和植物細胞中非病毒DNA的轉移。但是,轉化還表示引起動物細胞表型發生性改變的特定事件或一系列事件,暗示遺傳不穩定性及發展為癌癥狀態。盡管從這個意義上講,轉化可以源于轉化病毒的感染或基因轉染,也可以同時發生或在外來刺激物(如離子輻射或化學致突變源)刺激下產生。因此,在描述外源性遺傳物質導入時,應避免將該術語用于動物細胞。
轉導
轉導用于描述病毒介導的DNA轉移。但是,術語轉染也可以表示細胞的病毒核酸(從真核細胞病毒或噬菌體中分離)感染。
轉染的兩個主要目的是生成重組蛋白,或特異性地提升或抑制轉染細胞中的基因表達。因此,轉染是一種功能強大的分析工具,可用于基因或基因產物的功能和調控研究,用于生成轉基因生物,并用作基因治療方法。
基因表達
轉染最常通過使用質粒載體或mRNA在培養細胞(或動物模型)中表達目的蛋白。利用真核細胞中的蛋白表達可以生成經過適當折疊和翻譯后修飾的重組蛋白。另外,將帶有可檢測的標記物及其他修飾的蛋白質導入細胞,可用于啟動子和增強子序列或蛋白: 蛋白相互作用的研究。
此外,根據轉染策略的不同,轉染還可應用于各種形式的生物生產。例如,導入重編程轉錄因子可以生成誘導多能性干細胞(iPSC)。另一方面,穩定轉染提供了不同治療分子的生物生產方法。
基因抑制
轉染的另一個常用用途是通過RNA干擾(RNAi)抑制特定蛋白質的表達。在哺乳動物細胞中,利用內源性表達的非編碼RNA,以microRNA (miRNA)的形式-來源于雙鏈RNA(dsRNA)前體-完成RNAi。前體被加工成成熟miRNA,成為RNA誘導的沉默復合物(RISC)的一部分,抑制互補靶mRNA的翻譯。載體系統表達miRNA前體或短發夾RNA (shRNA)前體,它們通過內源性機制分別生成miRNA或shRNA,然后抑制基因表達。利用這些系統可以實現重組體的穩定轉染,并允許前體分子的誘導型表達。
化學合成的短/小分子干擾RNA (siRNA)還可以整合形成RISC,通過靶向互補mRNA (降解)誘導基因沉默。siRNA修飾有助于防止脫靶效應,還可以確保dsRNA的活性鏈整合至RISC中。
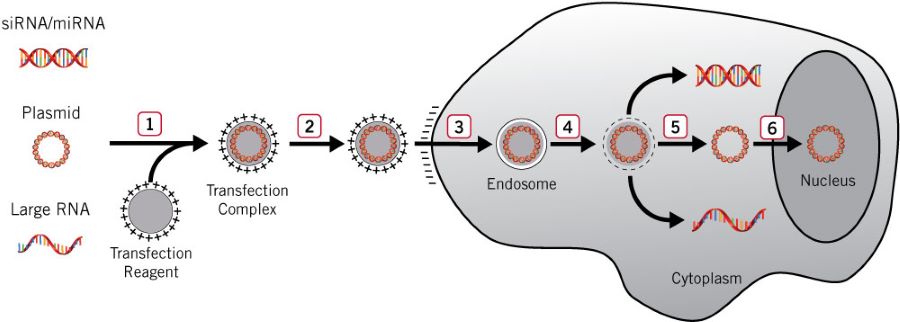
轉染類型:
將核酸導入細胞的生物、化學和物理方法有很多種。并非所有方法均適用于所有的細胞類型和實驗應用,不同方法的轉染效率、細胞毒性、對正常生理學的影響和基因表達水平各異。但是,所有轉染策略均可分為兩大類,其中一些導入核酸在細胞中存在一段時間(瞬時轉染),而另一些則長時間存在于細胞中,并被傳遞至轉染細胞的子代(穩定轉染)。
瞬時轉染
在瞬時轉染中,導入核酸只在細胞中存在一段時間,且未整合至基因組。因此,在細胞分裂過程中,瞬時轉染的遺傳物質不會傳遞至下一代,其會在環境因素影響下丟失或在細胞分裂過程中被沖淡。但高拷貝數的轉染遺傳物質會引起蛋白質的高水平表達(在其存在于細胞期間)。
根據使用的重組體的不同,瞬時表達的轉基因可以在1至7天內檢出,但瞬時轉染的細胞一般在轉染后24至96小時收獲。基因產物分析需要提取RNA或蛋白質進行酶活性分析或免疫分析。更佳時間間隔取決于細胞類型、研究目標和導入基因特定的表達特性,以及報告基因達到穩態所需的時間。但在數天內,大部分外源性DNA會在核酸酶作用下降解或被細胞分裂沖淡;一周后便無法再測出。
使用超螺旋質粒DNA進行瞬時轉染的效率更高,因為它能被細胞更地攝取。siRNA、miRNA、mRNA甚至蛋白質也可用于瞬時轉染,但與使用質粒DNA一樣,這些大分子需要達到高質量和相對高純度。在轉染DNA進入細胞核轉錄的同時,轉染RNA仍保留在胞漿內,它可在轉染(mRNA)幾分鐘內表達或者與mRNA結合,使靶基因表達沉默(siRNA和miRNA)。

上圖為LUYOR-3415RG照射煙草葉片中的GFP瞬時表達
穩定轉染
在穩定轉染中,外源性DNA被整合至細胞基因組中,或者作為附著體質粒存在。與瞬時轉染不同,穩定轉染可以使外源性DNA長期存在于轉染細胞及其子代細胞中。因此,穩定轉染可以使導入基因在多代細胞中性地表達,適用于重組蛋白生產和外源性DNA表達的下游或長期效應分析。但是,通常只有單個或幾個拷貝的外源性DNA被整合至穩定轉染細胞的基因組中。正因如此,穩定轉染基因的表達水平一般低于瞬時轉染基因的表達水平。
由于將外源性DNA穩定整合至基因組中的概率相對較低,因此成功完成穩定轉染需要DNA導入和篩選含有DNA的細胞的方法。篩選穩定表達轉染DNA的細胞的最可靠方法之一是在用于轉染的DNA重組體中加入選擇標記物,然后經過短暫的恢復期后,在細胞中應用適當的選擇壓力(參見第23頁的穩定轉染子的選擇)。
常用的選擇標記物是可傳遞對各種篩選藥物抗性的基因或可以補償轉染細胞系中缺陷必需基因的基因。使用選擇性培養基培養時,未轉染的細胞或瞬時轉染細胞最終都會死亡,而表達一定水平的抗生素抗性基因或可以補償必需基因缺陷的細胞則可以存活。在某些情況下,還可以將轉染細胞中的表型或形態學變化用作可篩選的特性。例如,采用源于牛乳頭瘤病毒的載體轉染小鼠CI127細胞,可出現形態學變化(Sarver et al .1981)。盡管相比超螺旋DNA,細胞對線性DNA的攝取量較低,但它可以將DNA更佳整合至宿主基因組中(參見第30頁的影響轉染效率的因素)。一般而言,穩定轉染僅限于DNA載體,但使用選擇性DNA載體制備短發夾轉錄本,亦可將siRNA和miRNA穩定導入細胞內(參見第50頁的載體介導的RNAi)。但是,RNA分子本身無法用于穩定轉染。
選擇轉染策略
決定您需要瞬時轉染還是穩定轉染的因素是您所進行實驗的時間范圍和最終目標。瞬時轉染細胞一般在轉染后24–96小時收集,常用于研究基因或基因產物的短期表達效應,執行RNA干擾(RNAi)介導的基因沉默,或者快速生成小量重組蛋白。mRNA瞬時轉染可以更快速地提供結果;因為mRNA在胞漿中表達,無需轉移到細胞核,無需轉錄,轉染數分鐘后即可在部分系統中表達轉染mRNA。
相比之下,當需要長期基因表達或轉染細胞需要在多個實驗中使用時,則更多地選擇穩定轉染。由于將DNA載體整合至染色體中的概率較低,因此細胞的穩定轉染更麻煩、更具挑戰性,需要選擇性篩選和克隆分離。因此,穩定轉染通常用于大規模的蛋白質生產、長期藥理學研究、基因治療或長期基因調控機制研究。
隨著轉染試劑的問世,盡管哺乳動物細胞的瞬時轉染已可用于經過適當折疊和翻譯后修飾(當表達細菌細胞重組蛋白時則不適用)的重組蛋白的生產,表達毫克至克級重組蛋白則主要依賴于建立穩定的細胞系。最近,采用懸浮培養的HEK293和CHO細胞進行大規模的瞬時轉染,可以獲得大量重組蛋白,且無需經過麻煩的穩定細胞系建立過程。研究人員使用目的載體和懸浮培養的CHO或HEK293細胞,利用瞬時轉染進行重組蛋白表達,可在3至7天內生成毫克/升級正確折疊和糖基化的重組蛋白。
Expi293?表達系統是瞬時表達技術的一次巨大進步,可在哺乳動物細胞中實現快速且超高產量的蛋白生產。Expi293?表達系統采用Expi293?表達培養基對Expi293F?細胞進行高密度培養,使用基于陽離子脂質體的ExpiFectamine? 293轉染試劑,結合優化轉染增強劑進行轉染。所有組分協同作用,生成的蛋白產量較傳統培養系統(如FreeStyle? 29表達系統)高2至10倍,IgG和非IgG蛋白的表達水平可達>1g/L。臨床生物治療藥物通常使用穩定的高表達轉染子生產,因為它們可以在極大規模的生產中實現批次間一致性和低成本。但在許多藥物開發應用中,采用瞬時轉染方法快速篩選蛋白重組體具有一定的優勢,可以在不到一周內同時評估不同的候選分子。在許多情況下,可以在進行瞬時轉染的同時建立穩定細胞系(更費時費力,需要三個月以上)。