LUYOR-3109高強(qiáng)度紫外催化光源促銷
LUYOR-3109紫外光源采用了9顆365nm大功率led,安裝有二次光學(xué)透鏡,輸出紫外線強(qiáng)度高,...
2024-08-08
LUYOR-3109紫外光源采用了9顆365nm大功率led,安裝有二次光學(xué)透鏡,輸出紫外線強(qiáng)度高,...
2024-08-08
KillerRed是個完全由基因編碼的光毒性紅色熒光蛋白,可接受綠色光照(540~580nm)生成活...
2024-04-29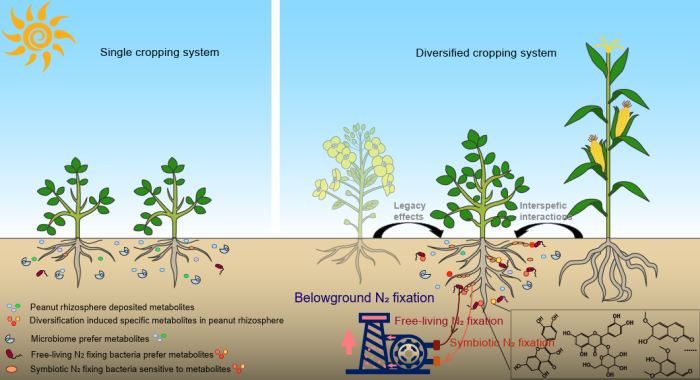
中國科學(xué)院南京土壤研究所彭新華研究員團(tuán)隊陳晏副研究員在農(nóng)田長期多樣化種植下,種間植物根際對話調(diào)控土壤...
2024-04-07咨詢熱線
021-64195798作者:時間:2019-11-18 15:41:28瀏覽9570 次
紅色熒光蛋白mCherry用于熒光標(biāo)記的研究報道逐漸增多,相對其他熒光蛋白,該熒光標(biāo)記具有標(biāo)記基因小、背景低等優(yōu)點,且與已報道的dsred2紅色熒光基因相比,其熒光強(qiáng)度及穩(wěn)定性更好。報道了利用mCherry熒光蛋白標(biāo)記蒙氏腸球菌ST4SA和植物乳桿菌423的研究,這是mCherry熒光蛋白標(biāo)記乳酸菌的報道,而國內(nèi)關(guān)于mCherry熒光蛋白標(biāo)記乳酸菌的研究尚未見報道。
乳酸菌(Lactic acid bacteria,LAB)是一類能夠利用碳水化合物發(fā)酵產(chǎn)生大量乳酸,降低發(fā)酵產(chǎn)品的pH值,不形成芽孢的革蘭氏陽性、兼性厭氧細(xì)菌的總稱[1-2]。大多數(shù)乳酸菌無毒、無害,對人體及動物體具有益生作用,因此被稱為益生菌[3-5]。隨著近20幾年來分子生物學(xué)的發(fā)展,以乳酸菌作為表達(dá)載體的基因表達(dá)系統(tǒng)的構(gòu)建和應(yīng)用成為目前的研究熱點之一,一些外源基因也被報道在乳酸菌中表達(dá)成功[6]。例如,Renye等[7]利用在乳酸菌表達(dá)中常用的Nisin (乳酸鏈球菌素)誘導(dǎo)表達(dá)系統(tǒng)NICE生產(chǎn)片球菌素;Abdullah等[8]用乳酸菌表達(dá)菌株中常用的乳酸乳球菌NZ9000表達(dá)了大腸桿菌的熱休克蛋白DnaK。
熒光蛋白具有穩(wěn)定性強(qiáng)、無物種專一性、易于在細(xì)胞內(nèi)表達(dá)等特點[9-10],因此,已作為標(biāo)記物而廣泛應(yīng)用于生命科學(xué)領(lǐng)域[11-15]。目前,國內(nèi)已有熒光蛋白成功標(biāo)記乳酸菌的報道,但相關(guān)研究成果并不多。2009年,陳曉雷等[16]構(gòu)建了綠色熒光蛋白GFP標(biāo)記穿梭表達(dá)載體pW425et-GFP,實現(xiàn)了綠色熒光蛋白GFP在嗜酸乳桿菌1.1878中的表達(dá)。2014年,徐一軻[17]成功構(gòu)建了表達(dá)增強(qiáng)型綠色熒光蛋白eGFP的重組乳酸乳球菌BLCC02-0018。2017年寇田田等[18]構(gòu)建了以紅色熒光蛋白基因(dsred2)為標(biāo)記,以α-淀粉酶(amy)為報告基因的表達(dá)載體,成功實現(xiàn)了融合基因dsred2-amy在干酪乳桿菌中的融合表達(dá)。前人報道表明不同熒光蛋白對不同宿主乳酸菌的標(biāo)記能力有強(qiáng)弱,因此,更多的熒光蛋白標(biāo)記需要被開發(fā)及應(yīng)用于更多乳酸菌宿主菌株。
近年來,紅色熒光蛋白mcherry用于熒光標(biāo)記的研究報道逐漸增多,相對其他熒光蛋白,該熒光標(biāo)記具有標(biāo)記基因小、背景低等優(yōu)點,且與已報道的dsred2紅色熒光基因相比,其熒光強(qiáng)度及穩(wěn)定性更好[19-25]。2015年van Zyl等[26]報道了利用mCherry熒光蛋白標(biāo)記蒙氏腸球菌ST4SA和植物乳桿菌423的研究,這是mCherry熒光蛋白標(biāo)記乳酸菌的報道,而國內(nèi)關(guān)于mCherry熒光蛋白標(biāo)記乳酸菌的研究尚未見報道。本文開展了mCherry熒光蛋白對植物乳桿菌的標(biāo)記研究,選用的植物乳桿菌WCFS1菌株是全基因組序列率先公布的乳酸桿菌,不僅自身具有益生和腸道中高存活率特性[27],同時已有多個外源蛋白在該菌株中表達(dá)成功的報道[28-30],是公認(rèn)的乳酸菌分子生物學(xué)研究中的模式菌株。膽鹽水解酶BSH是本實驗室研究多年的乳酸菌功能性酶,近期研究報道該酶可能和乳酸菌腸道定植相關(guān)[31-32]。因此,本文通過建立以mCherry熒光蛋白為標(biāo)記、膽鹽水解酶基因bsh為報告基因的融合蛋白表達(dá)系統(tǒng),為更多外源活性蛋白在乳酸菌中進(jìn)行功能性研究奠定基礎(chǔ),也為研究乳酸菌在生物體內(nèi)的定位、示蹤及益生性作用機(jī)制提供有效的技術(shù)手段。
1 材料與方法
1.1 材料
1.1.1 菌株和質(zhì)粒
1.1.2 培養(yǎng)基及培養(yǎng)條件
大腸桿菌DH5α用LB培養(yǎng)基37 ℃振蕩培養(yǎng)。植物乳桿菌用MRS培養(yǎng)基37 ℃靜置培養(yǎng)。在大腸桿菌中,氨芐青霉素、卡那霉素和紅霉素使用濃度分別為100 μg/mL、30 μg/mL和250 μg/mL。在乳酸菌中,紅霉素使用濃度為10 μg/mL,誘導(dǎo)劑SppIP使用濃度為25 ng/mL。
1.1.3 引物
mCherry和egfp基因序列的特殊性設(shè)計共用引物如下:P1和P2,此對引物引入了NdeⅠ和XbaⅠ兩個酶切位點。根據(jù)質(zhì)粒pSIPH462上bsh基因序列,設(shè)計引物:bsh1和bsh2,在目標(biāo)片段兩端皆引入XbaⅠ酶切位點。根據(jù)GenBank (登錄號為AL935263.2)的WCFS1上ldhL基因的啟動子序列、質(zhì)粒pMG36e上P32啟動子序列和GenBank (登錄號為CP000416.1)的短乳桿菌ATCC 367上slpA基因的啟動子序列,分別設(shè)計引物對如下:PldhL1-PldhL2、P32F-P32R以及PslpA1-PslpA2,上游引物皆引入BglⅡ酶切位點,下游引物皆引入NcoⅠ和NdeⅠ兩個酶切位點。引物均由生工生物工程(上海)股份有限公司合成。本實驗所需引物序列見表 2。
1.1.4 主要試劑及儀器
限制性內(nèi)切酶NdeⅠ、XbaⅠ、EcoRⅠ、BglⅡ、HindⅢ、rTaq、Ex Taq、DNA marker、PrimerStar Max和DNA切膠回收試劑盒購自寶生物工程(大連)有限公司;氨芐青霉素、卡那霉素、紅霉素、溶菌酶、SanPrep柱式質(zhì)粒DNA小量抽提試劑盒、Bradford法蛋白濃度測定試劑盒、茚三酮等均購自生工生物工程(上海)股份有限公司;SppIP誘導(dǎo)肽(序列:MAGNSSNFIHKIKQIFTHR)也由生工生物工程(上海)股份有限公司合成;T4 DNA連接酶購自NEB(New England Biolabs)公司;His標(biāo)簽抗體等購自美國Cell Signaling公司。牛磺膽酸鈉(Sodium Taurocholate,TCA)購自美國Sigma公司。
Personal PCR儀,AG 4309型高壓脈沖電擊轉(zhuǎn)化儀,1 mm電擊杯,CL-22M型高速冷凍離心機(jī),德國Eppendorf公司;Gel Doc XR+型凝膠成像系統(tǒng),美國Bio-Rad公司;HE-90型電泳儀,水平電泳槽,上海天能科技有限公司;高強(qiáng)度紫外線燈,美國路陽儀器設(shè)備有限公司;生物樣品勻質(zhì)器,杭州奧盛儀器有限公司;IX73型倒置熒光顯微鏡,日本Olympus公司;Infinite 200 PRO酶標(biāo)儀,瑞士TECAN公司。
1.2 方法
1.2.1 熒光蛋白eGFP和mCherry表達(dá)載體的構(gòu)建及鑒定
以載體pTracer-CMV3和pmCherry-C1質(zhì)粒DNA為模板,利用引物P1和P2分別擴(kuò)增egfp和mCherry基因,分別用NdeⅠ和XbaⅠ雙酶切,與經(jīng)相同酶切處理的pSIPH460載體片段連接,連接液轉(zhuǎn)化大腸桿菌DH5α感受態(tài)細(xì)胞,在含紅霉素的LB平板上篩選。構(gòu)建獲得的處于啟動子PsppA調(diào)控下的egfp基因和mCherry基因的誘導(dǎo)型重組載體分別命名為pSIPH471和pSIPH472。電轉(zhuǎn)化植物乳桿菌WCFS1感受態(tài)細(xì)胞后,獲得的重組菌命名為YeG471和YmC472,含空載質(zhì)粒pSIPH460的對照菌株命名為YE460。
1.2.2 熒光蛋白mCherry-BSH融合表達(dá)載體的構(gòu)建及鑒定
以本實驗室保藏的含羅伊氏乳桿菌膽鹽水解酶bsh基因的pSIPH462質(zhì)粒為模板,利用引物對bsh1和bsh2通過PCR擴(kuò)增bsh基因,用XbaⅠ單酶處理回收片段,與經(jīng)相同酶處理的pSIPH472載體進(jìn)行連接,含紅霉素的LB平板上篩選,獲得的陽性克隆命名為pSIPH473。將pSIPH460、pSIPH462、pSIPH472和pSIPH473先后電轉(zhuǎn)化植物乳桿菌NB5462的感受態(tài)細(xì)胞中,獲得的重組菌株相應(yīng)命名為YbE460、YbB462、YbmC472和YbBmC473。
1.2.3 組成型熒光蛋白mCherry-BSH融合表達(dá)載體的構(gòu)建及鑒定
以植物乳桿菌WCFS1全基因組、質(zhì)粒pMG36e及短乳桿菌ATCC 367全基因組為模板,利用PldhL1-PldhL2、P32F-P32R和PslpA1-PslpA2引物對,分別擴(kuò)增PldhL、P32和PslpA 3種啟動子DNA片段,然后進(jìn)行TA克隆。測序正確的3種陽性克隆質(zhì)粒經(jīng)NdeⅠ和BglⅡ雙酶切后,分別與經(jīng)相同酶處理的pSIPH473連接,構(gòu)建獲得的含啟動子PldhL、P32和PslpA的載體分別命名為pLDHLH673、pP32H771和pSLPAH871。電轉(zhuǎn)化植物乳桿菌NB5462的感受態(tài)細(xì)胞后,獲得的重組菌株相應(yīng)命名為YbBmC673、YbBmC771和YbBmC871。
1.2.4 重組蛋白的表達(dá)及Western blotting鑒定
誘導(dǎo)型重組菌株經(jīng)25 ng/mL SppIP誘導(dǎo)表達(dá)過程按照Nguyen等所述方法進(jìn)行[28, 33]。制備的粗酶液用Bradford法蛋白濃度測定試劑盒檢測蛋白濃度,并通過調(diào)節(jié)蛋白濃度,使取液量中總蛋白量一致,12% SDS-PAGE檢測。轉(zhuǎn)PVDF膜,TBST洗滌10 min,浸于5%脫脂乳封閉液中,室溫下封閉1 h。封閉結(jié)束后,經(jīng)TBST振蕩洗滌,加入稀釋比例為1:2 500 His標(biāo)簽抗體孵育液,孵育1 h后洗滌顯色。
1.2.5 重組蛋白表達(dá)的熒光活性觀察與檢測
將誘導(dǎo)表達(dá)或連續(xù)培養(yǎng)的菌液離心收集沉淀,用PBS洗滌2次,取10 μL滴于載玻片上,蓋上蓋玻片,在倒置熒光顯微鏡下分別觀察綠色和紅色熒光。
為建立生長曲線和熒光強(qiáng)度變化趨勢線,重組菌株于100 mL培養(yǎng)液中生長,每隔2 h取樣,直至培養(yǎng)34 h停止。樣品經(jīng)PBS洗滌后,利用紫外分光光度計和酶標(biāo)儀分別檢測樣品OD600值和熒光強(qiáng)度值,eGFP熒光蛋白于激發(fā)波長EX:488 nm和發(fā)射波長EM:511 nm下檢測熒光強(qiáng)度,mCherry熒光蛋白于激發(fā)波長EX:587 nm和發(fā)射波長EM:620 nm下檢測熒光強(qiáng)度[24]。
1.2.6 重組蛋白表達(dá)的膽鹽水解酶活性測定
重組蛋白表達(dá)方法見1.2.4,膽鹽水解酶BSH活性測定方法參考文獻(xiàn)[34]做少許修改。培養(yǎng)后的重組菌株,經(jīng)離心,用1 mL 0.1 mol/L的PBS(pH 6.0)洗滌2次,沉淀重懸于500 μL PBS中。吸取100 μL菌懸液至1.5 mL的離心管中,反應(yīng)體系200 μL,底物牛磺膽酸鈉(TCA)終濃度20 mmol/L。水解反應(yīng)于37 ℃水浴1 h,加入200 μL 15%三氯乙酸終止反應(yīng),立即12 000 r/min離心10 min,取100 μL上清液與900 μL茚三酮溶液混合,沸水浴14 min,冰浴5 min后測OD570數(shù)值計算酶活。根據(jù)牛磺酸-茚三酮標(biāo)準(zhǔn)曲線,得樣本中游離氨基酸濃度,計算BSH酶活。一個酶活單位(U)定義為每分鐘每毫升菌液與底物反應(yīng)后釋放出的游離氨基酸的量μmol。

2 結(jié)果與分析
2.1 eGFP和mCherry熒光蛋白重組表達(dá)質(zhì)粒構(gòu)建及酶切鑒定
分別以質(zhì)粒pmCherry-C1和pTracer-CMV3的質(zhì)粒DNA為模板,PCR擴(kuò)增egfp和mCherry兩種熒光蛋白編碼基因,目的片段均為約750 bp (圖 1A),TA克隆后測序結(jié)果表明擴(kuò)增到的egfp和mCherry基因與質(zhì)粒公布的序列完全一致。依方法1.2.1構(gòu)建的重組質(zhì)粒經(jīng)NdeⅠ和XbaⅠ雙酶切鑒定,獲得預(yù)期大小片段,進(jìn)一步測序顯示重組表達(dá)質(zhì)粒pSIPH471 (含egfp基因)和pSIPH472 (含mCherry基因)構(gòu)建正確(圖 1B)。
2.2 eGFP和mCherry熒光蛋白的重組表達(dá)及熒光活性檢測
依方法1.2.4,在重組菌株誘導(dǎo)表達(dá)至3 h,取破碎后上清液做Western blotting檢測,如圖 2,結(jié)果顯示重組蛋白表達(dá)出與預(yù)期eGFP (28.7 kDa)和mCherry (28.3 kDa)蛋白分子大小一致的條帶,條帶大小約為28 kDa。空載對照菌株則沒有表達(dá)條帶。
將誘導(dǎo)表達(dá)3 h的重組乳酸菌YeG471和YmC472的菌懸液置于倒置熒光顯微鏡下觀察。結(jié)果表明,在對應(yīng)的熒光激發(fā)光條件下,重組eGFP菌株YeG471檢測到綠色熒光,但是由于視野內(nèi)背景綠色熒光也很強(qiáng),因此菌株的熒光標(biāo)記不明顯(圖 3A)。不同的是,重組mCherry菌株YmC472檢測到紅色熒光,但是由于視野內(nèi)背景沒有熒光,因此菌株的熒光標(biāo)記清晰而顯著(圖 3B)。該結(jié)果說明相比eGFP熒光標(biāo)記而言,mCherry紅色熒光蛋白更適用于標(biāo)記植物乳桿菌WCFS1,因此,本研究隨后確定了mCherry蛋白作為植物乳桿菌WCFS1的熒光標(biāo)記進(jìn)行深入研究。
2.3 誘導(dǎo)型mCherry-BSH融合表達(dá)載體的構(gòu)建、重組表達(dá)及活性鑒定
依方法1.2.2,將質(zhì)粒pSIPH462上來源于羅伊氏乳桿菌的膽鹽水解酶基因bsh克隆至pSIPH472質(zhì)粒mCherry基因的C端,構(gòu)建獲得mCherry-BSH融合表達(dá)載體,命名為pSIPH473。將質(zhì)粒pSIPH473電轉(zhuǎn)化植物乳桿菌NB5462后獲得的重組菌株命名為YbBmC473,構(gòu)建策略見圖 4。重組的融合蛋白mCherry-BSH編碼基因是在啟動子PsppA調(diào)節(jié)下表達(dá)的,由于該啟動子是誘導(dǎo)型啟動子,因此,融合蛋白mCherry-BSH的重組表達(dá)方式是誘導(dǎo)型的,需要向培養(yǎng)基中添加SppIP作為誘導(dǎo)劑從而開啟基因的表達(dá)。
依方法1.2.4,在重組菌株經(jīng)25 ng/mL SppIP誘導(dǎo)表達(dá)3 h后,取破碎后上清液進(jìn)行Western blotting檢測(圖 2),結(jié)果顯示重組蛋白表達(dá)出與預(yù)期mCherry-BSH融合蛋白(65.3 kDa)分子大小一致的條帶,條帶大小約為64 kDa。該結(jié)果說明了重組菌YbBmC473表達(dá)了mCherry-BSH融合蛋白。
將重組菌株YbBmC473活化轉(zhuǎn)接至相應(yīng)抗性培養(yǎng)基中,在OD600至0.3時加入誘導(dǎo)劑SppIP誘導(dǎo)蛋白表達(dá)。樣品經(jīng)測定后,建立了樣品菌濃度、紅色熒光強(qiáng)度以及膽鹽水解酶BSH酶活性隨時間變化曲線(圖 5)。首先,從重組菌生長情況來看(圖 5A),2個含mCherry基因的表達(dá)菌株YbBmC473和YbmC472與對照菌株之間無明顯差別,表明mCherry熒光蛋白的表達(dá)對乳酸菌WCFS1無毒或低毒性,不影響菌株生長。其次,從重組菌熒光產(chǎn)生結(jié)果(圖 5B)來看,重組菌YbmC472和YbBmC473均檢測到熒光,2個菌株產(chǎn)生熒光的趨勢相一致,即經(jīng)SppIP誘導(dǎo)后熒光強(qiáng)度均是在菌體生長對數(shù)期中期(10 h)達(dá)到更高(37907 RFU和33707 RFU),隨后逐漸下降,其中,融合了BSH蛋白的重組菌YbBmC473熒光強(qiáng)度略低。該結(jié)果說明單獨(dú)表達(dá)的mCherry熒光蛋白可成功標(biāo)記植物乳酸菌WCFS1,而融合目的蛋白后仍舊表達(dá)較高熒光強(qiáng)度。最后,從重組菌膽鹽水解酶BSH活性表達(dá)情況來看(圖 5C),融合了mCherry基因重組菌株YbBmC473檢測到了BSH酶活性,酶活的產(chǎn)生趨勢與該菌株熒光產(chǎn)生趨勢相一致,在菌株發(fā)酵對數(shù)期中期(10 h) BSH活性更高,為0.603 U/mL,略低于bsh基因單獨(dú)表達(dá)菌株YbB462。該結(jié)果說明mCherry-BSH蛋白融合表達(dá)成功,融合后的蛋白同時具有較高的熒光強(qiáng)度和BSH酶活性。
綜上所述,本研究實現(xiàn)了誘導(dǎo)型mCherry-BSH重組蛋白在植物乳桿菌WCFS1中的融合表達(dá),該結(jié)果不僅成功建立了利用mCherry熒光蛋白標(biāo)記植物乳桿菌WCFS1的有效方法,同時,對目標(biāo)蛋白熒光標(biāo)記的成功,也為在以植物乳桿菌WCFS1為例的乳酸菌宿主中異源表達(dá)重組蛋白的研究提供了有利條件。
2.4 組成型mCherry-BSH融合表達(dá)載體的構(gòu)建、重組表達(dá)及活性鑒定
在構(gòu)建獲得的質(zhì)粒pSIPH473基礎(chǔ)上,本研究另外構(gòu)建了3種不同啟動子調(diào)節(jié)下的mCherry-BSH融合蛋白表達(dá)載體,質(zhì)粒的構(gòu)建策略見圖 6。本研究選擇的另外3種啟動子均來源于乳酸菌,且都是被報道在乳酸菌中成功表達(dá)外源基因的啟動子。與PsppA不同的是,來源于植物乳桿菌的PldhL、乳酸乳球菌的P32和短乳乳桿菌的PslpA均是組成型啟動子,在此類啟動子調(diào)節(jié)下,重組蛋白的表達(dá)過程中無需添加誘導(dǎo)劑。
以重組菌YbBmC473為對照,首先研究了3種組成型表達(dá)重組菌熒光表達(dá)情況,見圖 7。與誘導(dǎo)型重組菌YbBmC473熒光產(chǎn)生的趨勢不同,組成型重組菌的熒光強(qiáng)度在菌株生長穩(wěn)定期(16 h)達(dá)到更高,且維持較長時間。在3種不同的啟動子調(diào)節(jié)下,重組的mCherry-BSH融合蛋白表達(dá)的熒光強(qiáng)度也不同。其中,啟動子PldhL調(diào)節(jié)下重組菌YbBmC673熒光強(qiáng)度更高,培養(yǎng)16 h后熒光值為23 897 RFU,啟動子P32調(diào)節(jié)下重組菌YbBmC771熒光強(qiáng)度較低,為13 379 RFU,而啟動子PslpA調(diào)節(jié)下重組菌YbBmC871沒有檢測到熒光。值得注意的是,熒光強(qiáng)度更高的組成型表達(dá)重組菌YbBmC673其熒光強(qiáng)度明顯低于誘導(dǎo)型表達(dá)重組菌YbBmC473。
隨后,研究了更大熒光強(qiáng)度產(chǎn)生條件下的各個mCherry-BSH融合蛋白表達(dá)重組菌的BSH酶活性。結(jié)果顯示(圖 7),各個菌株的膽鹽水解酶BSH活性高低與其融合的mCherry蛋白熒光強(qiáng)弱相對應(yīng),即誘導(dǎo)型表達(dá)重組菌BSH活性更高,為0.637 U/mL (發(fā)酵10 h),明顯高于組成型表達(dá)重組菌,且啟動子PldhL調(diào)節(jié)下重組菌YbBmC673的BSH酶活性更高,為0.416 RFU (發(fā)酵16 h),啟動子P32調(diào)節(jié)下重組菌YbBmC771的BSH酶活性次之,而啟動子PslpA調(diào)節(jié)下重組菌YbBmC871沒有檢測出BSH酶活性。
以上結(jié)果表明,在啟動子PldhL調(diào)節(jié)下,組成型mCherry-BSH重組蛋白在植物乳桿菌WCFS1中也成功實現(xiàn)了融合表達(dá),該表達(dá)過程中無需添加誘導(dǎo)劑,簡化了表達(dá)過程。
3 討論
本研究利用mCherry紅色熒光蛋白成功標(biāo)記了植物乳桿菌WCFS1,是繼2015年van Zyl等[26]報道之后mCherry熒光蛋白成功標(biāo)記乳酸菌的又一例證,填補(bǔ)了國內(nèi)空白。目前,已有一些文獻(xiàn)報道了eGFP蛋白可標(biāo)記乳酸菌產(chǎn)生綠色熒光[35-37],但是本研究結(jié)果表明,由于WCFS1菌體自身綠色熒光背景高,eGFP標(biāo)記植物乳桿菌并不合適。相反,mCherry熒光蛋白標(biāo)記植物乳桿菌則具有優(yōu)勢,由于WCFS1菌體自身無紅色熒光背景,隨著mCherry基因的誘導(dǎo)表達(dá),重組菌檢測到明顯的紅色熒光。本研究建立的采用mCherry蛋白標(biāo)記植物乳酸菌的方法,可廣泛應(yīng)用于其他乳酸菌的熒光標(biāo)記工作中,為研究乳酸菌在生物體內(nèi)的分布、定植及存活情況從而揭示其益生功能的作用機(jī)理提供了有利條件。
目前,由于菌體自身安全、不分泌內(nèi)毒素、表達(dá)外源蛋白無需純化可直接同菌體一起進(jìn)入胃腸道以及自身具有益生功能等優(yōu)點,乳酸菌已然成為極具潛力的“新興”基因工程菌,具有廣闊的應(yīng)用前景和研究價值。本研究選取的植物乳桿菌WCFS1菌株便是重要的基因工程模式菌株,已經(jīng)有細(xì)胞因子、功能蛋白以及疫苗藥物分子等在WCFS1中表達(dá)成功的報道[27-30, 38-39]。本研究構(gòu)建了紅色熒光蛋白mCherry基因和乳酸桿菌降膽固醇功能關(guān)鍵酶膽鹽水解酶bsh基因的融合表達(dá)系統(tǒng),轉(zhuǎn)化植物乳桿菌WCFS1后,重組的融合蛋白mCherry-BSH同時檢測到紅色熒光和BSH酶活性,且兩蛋白活性表達(dá)互不影響。可以預(yù)見,易于觀察、便于檢測的mCherry紅色熒光蛋白將為更多活性蛋白在乳酸菌宿主中的表達(dá)、細(xì)胞定位、功能鑒定的研究奠定基礎(chǔ)。
此外,本文還研究了3種不同組成型啟動子調(diào)節(jié)下mCherry紅色熒光融合蛋白表達(dá)情況,相較于PslpA調(diào)控的基因轉(zhuǎn)錄在WCFS1中無蛋白活性,在啟動子PldhL調(diào)節(jié)下,融合蛋白mCherry-BSH具有較高的活性,且表達(dá)過程無需添加誘導(dǎo)劑。雖然實驗結(jié)果顯示組成型融合蛋白mCherry-BSH的蛋白活性不及誘導(dǎo)型,但是,無需添加誘導(dǎo)劑簡化了操作過程,特別在誘導(dǎo)劑添加困難的目的蛋白表達(dá)研究中(如重組菌在實驗動物胃腸道環(huán)境中表達(dá)蛋白)具有優(yōu)勢。值得注意的是,本研究構(gòu)建獲得的mCherry紅色熒光融合蛋白表達(dá)系統(tǒng)也可作為植物乳桿菌啟動子探針,為啟動子的篩選提供有效工具。