LUYOR-3109高強度紫外催化光源促銷
LUYOR-3109紫外光源采用了9顆365nm大功率led,安裝有二次光學透鏡,輸出紫外線強度高,...
2024-08-08作者:時間:2019-11-29 16:53:27瀏覽8537 次
化學發光,特別是基于生物酶的化學發光即生物發光,提供了極靈敏的檢測信號,因而在實際應用中具有諸多優勢。熒光素酶如螢火蟲熒光素酶、細菌熒光素酶、海腎熒光素酶,以及近年來出現的幾種低分子量熒光素酶,具有不同的酶催化特性及理化特征。它們應用于蛋白質片段互補與共振能量轉移技術等各種生化檢測方法,為觀察蛋白質相互作用提供了更安全便捷的手段,拓寬了蛋白質相互作用檢測技術的適用范圍。
蛋白質相互作用參與細胞的多項生理活動,如信號轉導、基因表達調控、核轉運、膜泡運輸、細胞遷移。它們既可調節生物體生長繁殖、新陳代謝、以及細胞的凋亡與壞死等過程[1] ,也能介導腫瘤、神經退行性變、病毒感染等多種疾病的發生與發展。在生命科學領域,對蛋白質相互作用的研究日益廣泛,受到更多重視。多種生物化學方法如蛋白質片段互補、共振能量轉移、免疫共沉淀、酵母雙雜交、下拉實驗等可用來觀察蛋白質相互作用。此外,一些生物物理方法,如表面等離子共振、等溫滴定量熱法、核磁共振、質譜等也常用于該領域的研究。采用化學發光特別是其中的生物發光技術應用于上述生物化學方法,具有獨特的優勢。
1 化學發光與生物發光
化學發光通常指物質在常溫下發生化學反應時伴隨的發光現象,實質為反應過程中生成的激發態化學產物在躍遷到基態時產生光輻射[2] 。將化學發光作為檢測信號在實際應用中具有許多優勢。,化學發光,特別以生物發光為代表,理論上其反應產生的每1 個激發態產物都會釋放1 個光量子,具有很高的能量轉移效率(量子產率)。利用光電倍增管可實現單光子計數,靈敏度極高。第二,在體內和體外的反應體系中,均不存在內源的化學發光,因此背景噪音極低。第三,化學發光反應中的能量-光量子偶聯的性,決定了產生的光信號線性變化區間極寬。利用的監測手段,可獲得理想的檢測范圍。第四,高靈敏度的化學發光檢測可以在短時間內完成,具有快速、的優勢。第五,這種高度靈敏的特性使微量檢測成為可能,結合其快速簡便的優點,適于進行高通量篩選。第六,采用化學發光檢測獲得即時信號,可動態監測反應進程。第七,檢測光強度的儀器簡單,僅需光電倍增管或光電二極管以及相關轉換記錄信號的電子元件,而不需要激發光單元,易于進行自動化設置。化學發光檢測因具有上述優勢而廣泛應用于臨床檢驗、醫藥研發、環境監測、法醫鑒定、反恐及軍事領域。生物發光屬于化學發光的范疇,可見于一些特定的細菌、真菌、昆蟲、植物和海洋生物等種屬中。生物發光過程是由酶催化的化學反應。催化生物發光反應的酶統稱為熒光素酶(luciferase),其反應底物統稱為熒光素(luciferin)。常見的生物發光反應可以分為3 類,如Fig.1。
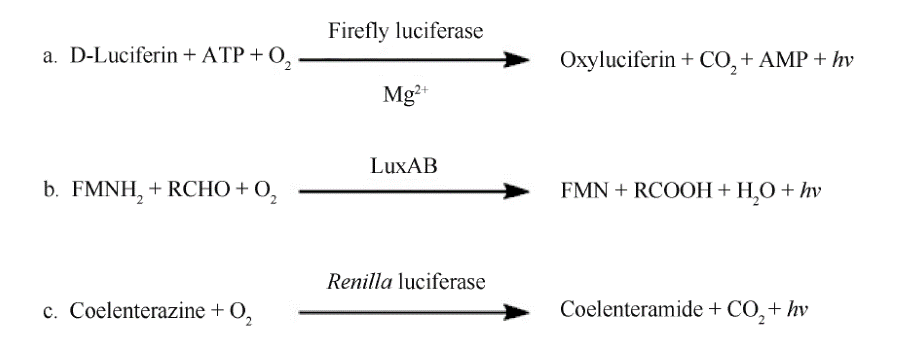
螢火蟲熒光素酶(firefly luciferase, FLuc)催化分子氧對其特異底物D-熒光素(D-luciferin) 的氧化,并由ATP 提供能量發生化學發光反應;Mg2+ 作為必需的輔因子維持酶的活性[3] 。FLuc 催化的發光反應分為兩個步驟:第1 步為底物與ATP 反應生成腺苷化中間產物;第2 步為中間產物與氧氣反應生成二氧化碳并伴隨發光。細菌熒光素酶(LuxAB)的催化反應同樣分為兩步[4] :第1 步,與LuxAB 結合的還原型黃素單核苷酸( reduced flavin
mononucleotide, FMNH2),經O2 氧化生成中間產物過氧化黃素;第2 步,過氧化黃素與底物長鏈脂肪醛反應生成脂肪酸,并伴隨發光。以海腎熒光素酶(Renilla luciferase, RLuc)為代表的多種海洋熒光素酶可催化腔腸素(coelenterazine)的氧化。該反應不需要ATP 及其他輔因子的參與,直接氧化底物產生化學發光。
在研究體系中,多數熒光素酶催化的生物發光具有閃光型(flash-type)的動力學特征,發光強度通常僅維持數分鐘,隨后迅速衰減;只有個別的熒光素酶產生輝光型(glow-type)的生物發光,光信號半衰期可達數十分鐘甚至數小時。通過反應體系的優化、酶或底物的分子改造,可以將閃光型生物發光轉變為輝光型,從而滿足不同的研究需求。基于幾種熒光素酶的生物發光檢測技術,近年來已成為這一領域的研究熱點。
2 常見熒光素酶及其特性
2. 1 螢火蟲熒光素酶
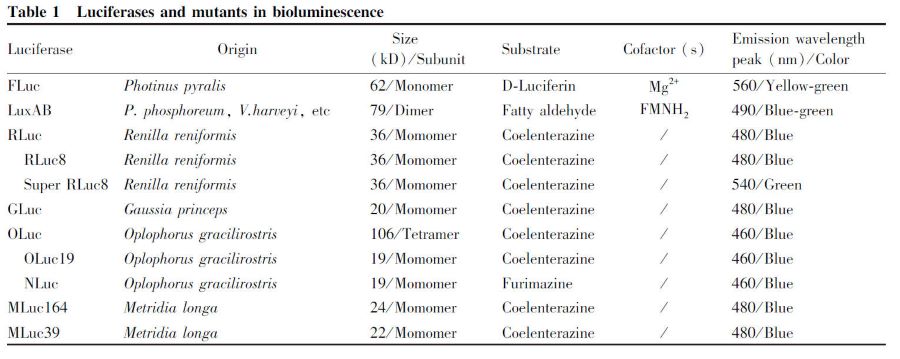
早在1885 年,在昆蟲中就發現了螢火蟲熒光素酶(FLuc)[5] 。上世紀80 年代,克隆了FLuc 的編碼基因,并在大腸桿菌中成功表達[6] 。不同螢火蟲來源的FLuc 可能存在一些差異。最常用的北美螢火蟲(Photinus pyralis) 來源的熒光素酶,是含有550 個氨基酸殘基的單體多肽鏈,分子量為62 kD。該酶催化ATP 依賴的化學發光反應,發射波長峰值為560 nm。對北美螢火蟲和日本源氏螢(Luciolacruciate)來源的FLuc,在某些氨基酸位點進行突變,可使其發射波長發生紅移[7, 8] 。這種紅移成因于激發態氧化型熒光素產物分子剛性的改變,影響了能量的遷移過程。野生型熒光素酶的發光強度及其發射波長隨環境pH 波動較大。通過257 位氨基酸突變,可獲得新型紅移的FLuc 突變體,其發射波長及發光強度可在不同pH 環境中維持穩定[9] 。FLuc發光機制明確,其化學發光的量子產率高達88%,信號強度高且背景噪音低,具有極高的檢測靈敏度和極寬的線性檢測范圍;其編碼基因能在細菌、酵母、哺乳動物細胞等多種體系中成功表達;且其突變體各異的發光特征滿足了多樣的研究需求。FLuc已迅速成為一種在分子生物學領域廣泛應用的研究工具。
2. 2 細菌熒光素酶
細菌熒光素酶LuxAB 是由兩個亞基組成的異二聚體,催化氧化長鏈脂肪醛,發射波長在490 nm左右[10] 。在陸生發光細菌如明亮發光桿菌(Photobacterium phosphoreum)和海洋發光細菌如哈氏弧菌(Vibrio harveyi)、費氏弧菌(Vibrio fischeri)中[11] ,Lux 基因操縱子除含LuxA(編碼分子量為42kD 的α 亞基)和LuxB(編碼分子量為37 kD 的β 亞基)外,還包含基因LuxC、LuxD 與LuxE,分別編碼參與底物脂肪醛加工的還原酶、轉移酶與合成酶[12] 。以Lux 基因為基礎,LuxAB 的應用為細菌學研究提供了簡便的研究工具。在真核細胞中,Lux 也成功作為報告基因[13] ,提示LuxAB 有更廣泛的應用范圍。LuxAB 也存在一定的缺陷:由于該蛋白質穩定性差,酶活性受溫度影響很大,常溫即易失活;在真核細胞中的發光強度較FLuc 低,靈敏度相對較差。通過LuxAB 的α 和β 亞基融合,并進一步改造,可獲得單體的細菌熒光素酶,熱穩定性明顯提高,并極大提高了量子產率[14] 。
2. 3 海腎熒光素酶
RLuc 是一種來自海洋腔腸動物海腎(Renillareniformis)的熒光素酶,為含有311 個氨基酸殘基的單體多肽鏈,分子量36 kD[15] 。它是個被廣泛應用的海洋來源熒光素酶,催化腔腸素產生化學發光,發射波長在480 nm 左右。其量子產率較FLuc低(7%),但該反應不需要ATP 及其他輔因子的參與,反應限制條件更少,在基于熒光素酶的生物發光檢測技術中同樣應用廣泛。
RLuc 在細胞及體內的穩定性差,影響檢測的靈敏度。RLuc 突變體RLuc-C124A 在鼠血清中的穩定性可提高6 倍[16] ;多個氨基酸位點突變獲得的RLuc8,在鼠血清中的穩定性提高200 倍,光亮度提高4 倍[17] ;新型突變體Super RLuc8 的酶分子熱穩定性提高,光信號半衰期顯著延長,發光波長紅移至綠光范圍[18] ,更適合應用于在體成像。
2. 4 新型低分子量熒光素酶
近10 余年來,從海洋生物中發現了幾種以腔腸素為催化底物的新型熒光素酶,它們通常具有較小的分子量約20 kD。低分子量熒光素酶分子理化性質一般更加穩定,在體內表達更具優勢,空間位阻相對較小,理論上對融合蛋白質間的相互作用影響更弱,目前更廣受重視,逐漸應用于多項領域。
2. 4. 1 Gaussia Luciferase (GLuc) GLuc 是從海洋橈足類動物Gaussia princeps 中發現的一種熒光素酶,分子量為19. 9 kD[19] 。其蛋白質序列由185 個氨基酸殘基組成,包含N 端17 個氨基酸殘基的分泌信號肽,使天然的GLuc 可分泌至細胞外。其序列中有11 個半胱氨酸殘基,形成5 對分子內二硫鍵,具有更穩定的理化性質,對高溫、低pH、過氧化氫環境更為耐受。研究表明,二硫鍵的正確形成是GLuc 具有催化活性的關鍵[20] ,但多對二硫鍵的存在也使通過大腸桿菌表達體系獲得活性蛋白質分子更為困難。GLuc 以天然腔腸素作為催化底物,發射波長峰值為480 nm。與FLuc 和RLuc 相比,GLuc發光強度更高。
GLuc 的發光信號衰減極為迅速,在一定程度上限制了它的應用。通過亮氨酸替換甲硫氨酸的策略,可使突變型GLuc 的發光信號半衰期延長,而保留GLuc 的發光活性[21] 。采用其他策略獲得的幾種GLuc 突變體,不僅發光信號半衰期延長,而且發光強度大幅提升,發射光譜紅移[22] 。
2. 4. 2 Oplophorus Luciferase ( OLuc) OLuc 是從深海蝦Oplophorus gracilirostris 中發現的一種熒光素酶,催化腔腸素發光[23] 。天然的OLuc 分子量為106 kD,包括2 個35 kD 的亞基和2 個19 kD 的亞基。研究表明,僅19 kD 的小亞基具有催化活性。19 kD 小亞基自身分子熱穩定性差,極易失活。經多位點隨機突變進行結構優化,篩選獲得一個包含171 個氨基酸殘基的熒光素酶突變體,具有良好的分子穩定性,命名為NanoLuc (NLuc)[24] 。NLuc與其母體分子OLuc19 一樣,在分子氧存在的條件下與底物作用產生生物發光,發射波長峰值在460nm 處。與FLuc 和RLuc 相比,NLuc 具有更穩定的性質:在8 mol/ L 尿素的變性條件下,或在55℃加熱30 min,可維持活性不變;在較寬的pH 范圍內均可發揮更大催化效能,并在偏酸的環境下保持一定活性。通過篩選一系列腔腸素類似物,還獲得1 個新型合成底物Furimazine[24] ,其理化性質更穩定,自發光水平更低,且對NLuc 的催化有更高的選擇性,二者組合可構成更為靈敏的檢測體系。NLuc 催化Furimazine 的生物發光反應,信號半衰期長達120min;產生的光信號更強。在細胞裂解液中,NLuc 比等摩爾的FLuc 和RLuc 發光信號強約150 倍。NLuc 融合不同功能片段(NLuc-PEST、secNLuc) 可獲得快速降解或分泌特性,更適于進行連續動態監測。目前,NLuc 的應用范圍與研究熱度遠超其母體分子OLuc19。
2. 4. 3 Metridia Luciferase ( MLuc) MLuc 是來源于另一種海洋橈足類動物Metridia longa 的熒光素酶。這種單亞基分子分為2 種亞型即MLuc164 和MLuc39,它們的分子量分別為24 kD 和22 kD。二者均以天然腔腸素作底物,發射波長為480 nm 左右[25, 26] 。MLuc 與GLuc 的氨基酸序列同源性較高,二者理化性質及發光特征也較為相似。相比其他熒光素酶,MLuc 不具有明顯優勢,故在各種生物發光檢測技術中應用較少。上述幾種熒光素酶基本特征總結如Table 1。
3 基于熒光素酶的作為蛋白質相互作用的檢測方法
各種熒光素酶,因其催化特征及獨特的分子特性,可以作為分析蛋白質相互作用的有效工具,發揮化學發光檢測的各項優勢,從而方便安全地獲得更靈敏的檢測結果。3. 1 蛋白質片段互補檢測蛋白質片段互補檢測( protein-fragment complementation assay, PCA)[27] 中傳統的報告蛋白質,如β-半乳糖苷酶、氯霉素乙酰轉移酶、熒光蛋白質等,可用熒光素酶替代。FLuc 在合適的位點分割為2 個片段,分別與2 個待測目的蛋白質融合表達,單獨的片段喪失其原有活性且無法自身結合。兩個目的蛋白質發生相互作用,可使熒光素酶片段結合互補,形成具有完整活性的非共價蛋白質復合體。目的蛋白質的相互作用可由FLuc 的催化活性,即化學發光信號來準確反映。常用的FLuc 互補片段為FLucN (2~416 aa)和FLucC (398~550 aa),其他分裂方式的互補片段, 也可構建適宜的檢測體系[28, 29] 。PCA 僅需2 種重組融合蛋白質參與,在極簡單的體外反應體系中即可檢測蛋白質相互作用。基于FLuc 片段互補檢測的體外檢測體系,在優化FLuc 片段的穩定性后,可進行高通量篩選[30] 。在哺乳動物細胞[31] 、擬南芥原生質體[29] 、絲狀子囊菌[28] ,甚至完整植物葉片[32] 及鼠[31] 等復雜體系中,也可用FLuc 片段互補觀察蛋白質相互作用。FLuc 極高的量子產率、良好的安全性以及生物發光較強的組織穿透能力,使該互補體系可在小動物水平實現連續動態觀察。
RLuc 的催化反應不需ATP 及其他輔因子,使其片段互補檢測具有獨特優勢。在一些特殊的細胞器如高爾基體中,由于缺少ATP,只能采用RLuc 代替FLuc 觀察蛋白質相互作用[33] 。RLuc 也可有不同的分割方式,如分割為1~229 aa 和230~311 aa,或1~110 aa 和111~311 aa 片段。利用RLuc 片段互補在哺乳動物細胞中可檢測多種蛋白質相互作用,如病毒蛋白質間及其與宿主蛋白質間的相互作用[34, 35] ;還在霍亂弧菌中,驗證了趨化相關應答調節因子CheY3 與其磷酸酶CheZ 間的相互作用[36] 。RLuc 互補片段的分子量顯著低于FLuc 的互補片段,也是RLuc 應用于PCA 的一個優勢。
GLuc 和NLuc 具有更低的分子量,其片段融合進一步減少了對目的蛋白質結合的空間位阻影響,更有利于觀察蛋白質相互作用,降低檢測的假陰性率。將GLuc 的C 端片段與趨化因子CXCL12 融合,N 端片段分別與其兩種受體融合,可在活細胞和小動物水平觀察趨化因子與其受體的結合,并用于篩選靶向相關受體的小分子抑制劑[37] 。利用GLuc 片段互補檢測體系的高靈敏度,可檢測細胞內低表達水平蛋白質間的相互作用,如研究蛋白質激酶B(protein kinase B, PKB)與轉錄激活因子Smad3 的結合,及胰島素和轉化生長因子-β ( transforminggrowth factor-β, TGF-β)對該結合的影響[38] 。應用GLuc 片段互補體系,還發現了細胞凋亡、自噬等相關信號通路中一些未知的蛋白質相互作用,促進了對細胞死亡網絡的理論構建[39] 。
Dixon 等[40] 利用NLuc 建立了獨特的NanoBiT(NanoLuc Binary Technology)片段互補體系。N 端18 kD 大片段與C 端1. 3 kD 小片段構成兩個互補片段;這個小片段不僅可與目的蛋白質融合表達,還可通過化學綴合方式方便地連接小分子多肽及結構復雜的蛋白質大分子,應用范圍進一步擴大。Zhao等[41] 設計了另一種特別的互補體系:1~65 aa (N)和66~171 aa (C)片段可自然組裝成全酶,將N 端片段與Aβ 蛋白或其他目的蛋白質融合,當目的蛋白質聚集時,加入的C 端片段不能與融合蛋白質互補,從而無法結合獲得全酶活性,由此評估蛋白質聚集傾向。基于該方法可建立高通量篩選蛋白質聚集抑制劑的平臺。
3. 2 基于FLuc 突變體的功能互補方法
依據與PCA 類似的原理, Ohmuro-Matsuyama等[42] 將位于FLuc 不同結構域的腺苷化與氧化活性中心[3] 分別突變,獲得了2 種FLuc 突變體。它們僅具有腺苷化功能或氧化功能,無法獨立催化底物產生化學發光。而與其融合的2 種目的蛋白質發生相互作用時,二者發生功能互補,共同催化發光。這種特別的基于FLuc 蛋白質相互作用檢測( firefly luciferase-based protein-protein interaction assay,FlimPIA) 技術, 在FK506 結合蛋白12 ( FK506 binding protein 12, FKBP12)與FKBP-雷帕霉素結合域(FKBP-rapamycin binding domain, FRB)相互作用模型中獲得了驗證。與FLuc 片段互補檢測方法相比,FlimPIA 彌補了熒光素酶片段穩定性差缺陷,增強檢測信噪比[43] ,但可能存在融合探針分子量較大所帶來的空間位阻問題。
3. 3 共振能量轉移技術
共振能量轉移技術中,能量供體與受體一般為熒光發色團,構成熒光共振能量轉移(fluorescence resonance energy transfer, FRET)[44] 。供體和受體分別與2 個目的蛋白質連接,可進行目的蛋白質間相互作用的研究。將熒光素酶代替熒光蛋白質作為能量供體, 即生物發光共振能量轉移(bioluminescence resonance energy transfer, BRET)技術[45] ,解決了傳統FRET 技術由于激發光導致的光毒性、光漂白等問題,降低樣品背景噪音,檢測靈敏度更高。
RLuc 與熒光蛋白質是BRET 檢測體系中常用的供體和受體。融合了目的蛋白質的供體和受體在細胞內共表達,可以在細胞水平展開研究,如檢測信號轉導通路中有關蛋白質的相互作用[46, 47] 。RLuc在應用時量子產率低,發光信號較弱,而采用突變體RLuc8,可獲得增強的檢測信號。RLuc8 與綠色熒光蛋白質配對,檢測了蛋白質激酶CK2 的聚集[48] ,以及G 蛋白偶聯受體與β-抑制蛋白間的結合[49] 。FLuc 催化的發光波長范圍與常用的熒光蛋白質發射光譜重疊,使其在BRET 系統中應用較為局限。為了利用FLuc 的高量子產率,有報道[50] 嘗試,將FLuc 與紅色熒光蛋白質配對,成功檢測了抗谷胱甘肽轉移酶抗體介導的谷胱甘肽轉移酶與G 蛋白間的相互作用。
Cui 等[51] 將單體LuxAB 及增強型黃色熒光蛋白質,分別與待測的兩個目的蛋白質融合,用于在原核體系中動態檢測蛋白質間相互作用。該檢測體系在幾種典型的蛋白質相互作用模型中獲得了驗證,并觀察到滲透壓和pH 值的改變對細菌調節蛋白OmpR 多聚化的影響,證實該體系監測動態蛋白質相互作用的可行性。
近幾年來,低分子量熒光素酶GLuc 和NLuc 在BRET 中的應用日趨普遍。NLuc 作為能量供體,可提供更穩定的檢測信號。利用NLuc 融合G 蛋白偶聯受體,能檢測其與各種熒光配體間的結合[52] 。將NLuc 與紅色熒光基團配對,在幾個蛋白質相互作用模型中驗證了該體系具有更廣泛的動力學檢測范圍[53] 。
3. 4 酵母雙雜交檢測
酵母雙雜交實驗是在活細胞體系中檢測蛋白質相互作用的一種常用分子生物學方法[54] 。將轉錄激活子的DNA 結合域和轉錄激活域分別與兩個待測目的蛋白質進行融合表達,兩種產物無法單獨激活轉錄;當兩個目的蛋白質發生相互作用而靠近時,DNA 結合域和轉錄激活域形成的復合體可激活下游報告基因的轉錄。通過對報告基因轉錄水平的檢測,可判斷目的蛋白質間是否存在相互作用。由于熒光素酶生物發光信號背景噪音更低,靈敏度更高,因此熒光素酶報告基因已取代編碼β-半乳糖苷酶、氯霉素乙酰轉移酶、熒光蛋白質等的傳統報告基因,成為主流的研究工具。FLuc 在細胞內的半衰期相對較短,可動態反映細胞中蛋白質相互作用情況,在熒光素酶報告基因中最為常用。此外,因GLuc、NLuc 等低分子量熒光素酶的獨特優勢,依據這些熒光素酶構建的報告基因體系受到越來越多的重視,目前已有商品化報告基因載體面市。
3. 5 基于熒光素酶示蹤的蛋白質相互作用研究方法
一些研究蛋白質相互作用的生化方法,有賴于親和基質吸附對蛋白質復合體的分離作用,如免疫共沉淀、下拉實驗等。這些方法中,有時需要對參與相互作用的某個蛋白質進行標記示蹤,從而觀察其相互作用。
實際上,多肽抗原與其抗體的相互作用,也可視為蛋白質相互作用的一種。在研究抗原抗體結合的免疫沉淀(immunoprecipitation, IP)技術中,同位素標記是經典的示蹤手段。利用熒光素酶對目的蛋白質進行示蹤,可取同位素,獲得非放射性標記探針。將熒光素酶與抗原融合表達制備探針,利用親和基質分離其與抗體形成的復合物。通過測定樣品中熒光素酶的活性,可分析抗原抗體間的相互作用。以RLuc 標記人呼吸道合胞病毒核蛋白,使用IP 技術檢測新生兒血清中呼吸道合胞病毒抗體,可作為診斷該病毒感染的靈敏指標[55] 。利用GLuc 標記鋅轉運蛋白,同樣可測定血清中抗鋅轉運蛋白抗體的含量,從而篩選1 型糖尿病高危人群[56] 。將NLuc與胰島素原融合,可用IP 技術成功檢測到1 型糖尿病患者血清中胰島素自身抗體,有望應用于臨床1型糖尿病的診斷工作[57] 。此外,將M 型磷脂酶A2受體(PLA2R)片段與NLuc 融合,通過IP 方法檢測自發抗體水平,可以確定疾病發展階段,區分原發性與繼發性膜性腎病,檢測疾病活動度及監測臨床療效[58] 。
類似地,利用FLuc 和RLuc 分別標記2 個待測目的蛋白質,將FLuc 定向結合于固相,通過測定RLuc/ FLuc 發光信號比例,成功檢測了Jun/ Fos 異二聚體形成、干擾素調節因子3 二聚化等多種蛋白質間相互作用[59] 。多肽配體與受體的結合是另一種典型的蛋白質相互作用。傳統的配體受體結合實驗采用同位素作為示蹤標記。低分子量熒光素酶NLuc 標記配體作為探針,與表達于細胞表面的膜受體進行結合測定,可獲得相應的受體配體結合的有效參數[60, 61] 。該方法的靈敏度可達到同位素方法水平,且操作更加簡便。
4 問題與展望
熒光素酶催化的生物發光及其檢測獨具特點和優勢。將幾種熒光素酶應用于蛋白質片段互補檢測、共振能量轉移、酵母雙雜交實驗、免疫沉淀等技術手段,彌補了傳統方法的不足,使蛋白質相互作用的研究過程更加方便快捷,有利于構建以蛋白質相互作用為靶向的多種藥物篩選模型,提供的藥物篩選平臺。
生物發光檢測也具有一定的局限性。首先,熒光素酶分子量相對較大,可能對融合目的分子產生一定的空間位阻,從而影響它們的相互作用,導致假陰性結果的產生。其次,熒光素酶作為一種蛋白質分子,酶活性易受反應體系組份、pH、溫度等多種因素的影響,表現為發光強度及波長范圍等的異常,干擾檢測數據的分析。同時,大部分熒光素酶的通用底物coelenterazine 穩定性較差,自氧化發光,產生一定的背景信號。此外,與傳統同位素標記、熒光分子標記、基于熒光蛋白質的片段互補等技術一樣,這些生物發光檢測方法,也無法直接區分由2 種蛋白質分子間的非特異性結合所產生的假陽性信號,需要更多實驗進一步鑒別。
回顧幾十年來的研究進展,熒光素酶正朝著穩定、低分子量、高發光強度的方向發展,底物分子結構也不斷優化,生物發光檢測技術應用范圍逐步拓寬。相信在今后的研究中,新型熒光素酶及其選擇性底物的涌現,可進一步完善現有生物發光檢測體系,使生物發光在更多研究領域獲得廣泛的應用。
文獻作者:宋曉菡, 王楠,中國醫學科學院& 北京協和醫學院藥物研究所新藥作用機制研究與藥效評價北京市重點實驗室,