LUYOR-3109高強度紫外催化光源促銷
LUYOR-3109紫外光源采用了9顆365nm大功率led,安裝有二次光學透鏡,輸出紫外線強度高,...
2024-08-08作者:生命科學事業部時間:2019-11-17 19:53:46瀏覽4287 次
慢病毒(Lentivirus)是逆轉錄病毒的一種。構建的siRNA / miRNA慢病毒載體,與化學合成的siRNA 和基于瞬時表達載體構建的普通 siRNA 載體相比,一方面可以擴增替代瞬時表達載體使用,另一方面,Lentivirus-siRNA克隆經過慢病毒包裝系統包裝后,可用于感染依靠傳統轉染試劑難于轉染的細胞系如原代細胞、懸浮細胞和處于非分裂狀態的細胞,并且在感染后可以整合到受感染細胞的基因組,進行長時間的穩定表達。
目的基因不能直接整合到大多數真核細胞,常用的手段是將目的基因包裝成病毒來感染細胞,從而得到表達滿足實驗需求。
1、病毒的種類
病毒有很多種,常見的有慢病毒和腺病毒
1.1慢病毒
1.1.1原理
慢病毒(Lentivirus)是逆轉錄病毒的一種。構建的siRNA / miRNA慢病毒載體,與化學合成的siRNA 和基于瞬時表達載體構建的普通 siRNA 載體相比,一方面可以擴增替代瞬時表達載體使用,另一方面,Lentivirus-siRNA克隆經過慢病毒包裝系統包裝后,可用于感染依靠傳統轉染試劑難于轉染的細胞系如原代細胞、懸浮細胞和處于非分裂狀態的細胞,并且在感染后可以整合到受感染細胞的基因組,進行長時間的穩定表達。
1.1.2特點
1)直接包裝成為假病毒顆粒,對分裂和非分裂細胞均有感染作用,適合 RNAi 研究和體內實驗中難于轉染的細胞 (比如神經元細胞、干細胞或其它原代細胞)。
2)可以通過簡單方式,在短時間內獲得穩定表達特定基因的多種細胞株。
3)可用于基因敲除、基因治療和轉基因動物研究。
4)無需任何轉染試劑,操作簡便。
5)可以根據客戶需要制備多種標記。
1.1.3慢病毒包裝簡要流程:
1)含有目的基因的慢病毒 RNAi 干擾載體的構建和質粒純化提取。
2)慢病毒載體,包裝系統共轉染病毒包裝細胞293T等。
3)培養 48hrs - 72hrs 左右,收集含有病毒的上清培養液。
4)病毒的純化和濃縮。
5)分裝、- 80 ℃保存。
6)滴度測定目的基因檢定,并出具檢測報告。
1.2、腺病毒
1.2.1原理
腺病毒(Adenovirus,Ad)是一種無包膜的線狀雙鏈DNA病毒,其復制不依賴于宿主細胞的分裂。有近50個血清型,大多數Ad載體都是基于血清型2和5,通過轉基因的方式取代E1和E3基因,降低病毒的復制能力。這些重組病毒僅在高水平表達E1和E3基因的細胞中復制,因此是一種適用于治療的控制系統。
1.2.2特點
1)幾乎可以感染所有類型的細胞
2)可以獲得復制缺陷型 (E1 和 E3 缺失) 的腺病毒
3)病毒滴度高,產生病毒經過濃縮后可以達到 1012 PFU/mL,能有效的進行增殖。
4)腺病毒載體感染宿主的范圍比較廣,制備容易,操作簡單.
5)感染細胞時,不整合到染色體中,不存在激活致癌基因或插入突變等危險,生物安全性高。
1.2.3腺病毒包裝簡要流程
1)構建表達 siRNA/miRNA 的腺病毒載體
2)采用 PacI 消化純化的質粒。
3)消化好的腺病毒表達載體轉染 293A 細胞,收獲細胞以制備病毒粗提液。
4)將病毒粗提液感染 293A 細胞以擴增病毒。
5)分裝,-80℃保存。
1.3、慢病毒和腺病毒的比較
慢病毒載體系統和腺病毒載體系統比較
| 病毒表達系統 | 慢病毒表達系統(Lentivirus) | 腺病毒表達系統(Adenovirus) |
| 病毒基因組 | RNA病毒 | 雙鏈DNA病毒 |
| 復制 | 自主復制 | 自主復制 |
| 是否整合 | 病毒基因組整合于宿主基因組,長時間、穩定表達外源基因 | 病毒基因組游離于宿主基因組外,瞬時表達外源基因 |
| 感染細胞類型 | 感染分裂和不分裂細胞,適用于難轉染的原代細胞(如神經細胞)及體內實驗 | 感染分裂和不分裂細胞 |
| 表達風度 | 中水平表達 | 高水平表達 |
| 表達時間 | 慢(1-3天) | 快(1-2天) |
| 滴度 | 滴度更高可達10*8pfU/ml | 滴度更高可達10*11pfU/ml |
| 克隆容量 | 可插入不超過8kb的外源片段,滴度隨插入片段長度增加而降低 | 可插入高達8kb的外源片段,滴度隨插入片段長度增加而降低 |
| 免疫原性 | 低免疫原性 | 高免疫原性 |
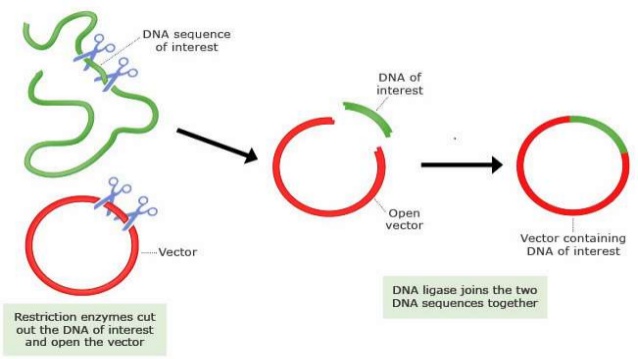
2、構建目的基因到載體
2.1構建手段
一般是根據原始質粒信息確定克隆方案,有以下兩種手段。
1)如果原始質粒與載體有匹配酶切位點,采用相應的內切酶切下相應片段,回收并連接到載體,酶切,并測序鑒定
2)如果沒有匹配的酶切位點,則設計帶有特殊接頭的引物進行PCR擴增,得到目的片段,采用相應的內切酶切下相應片段,回收并連接到穿梭載體,酶切,并測序鑒定
2.2質粒載體
2.2.1概念
能夠進行自主復制的環狀DNA雙鏈結構,包括真核生物的細胞器(主要指線粒體和葉綠體)中和細菌細胞擬核區以外的環狀脫氧核糖核酸(DNA)分子
2.2.2特征
質粒上常有抗生素的抗性基因,例如,四環素抗性基因或卡那霉素抗性基因等。有些質粒稱為附加體(episome),這類質粒能夠整合進真菌的染色體,也能從整合位置上切離下來成為游離于染色體外的DNA分子。質粒在宿主細胞體內外都可復制。通過個些特性,人們可以把一些目的DNA片斷構建在質粒中,通過轉化入大腸桿菌中,利用選擇培養基來篩選從而不斷的復制,來得到目的產物。
3、質粒DNA在大腸桿菌里轉化
連接上目的基因的質粒轉化大腸桿菌是為了讓目的基因在大腸桿菌里擴增,然后提取質粒,以下是質粒DNA在大腸桿菌里轉化的三步驟。
3.1大腸桿菌感受態細胞的制備
1)從大腸桿菌平板上挑取一個單菌落于3mlLB培養基的試管中,37℃振蕩培養過夜。
2)取0.4ml菌液轉接到40mlLB液體培養基中,37℃振蕩培養2~3h
3)菌液轉移到50ml離心管中,冰上放置10min
4)4℃離心10min(4000r/min)
5)倒出培養液,將管口倒置以便培養液流盡
6)用冰浴的0.1mol/L氯化鈣10ml懸浮細胞沉淀,立即冰浴30min
7)4℃離心10min(4000r/min)
8)倒出上清液,用冰浴的0.1mol/L氯化鈣2ml懸浮細胞(冰上放置)
9)分裝細胞,200ul一份,4℃保存
3.2質粒DNA的轉化
1)取200ul新鮮制備的感受態細胞,加入質粒DNA2ul混勻,冰浴30min
2)離心管放到42℃保溫90s
3)冰浴2min
4)每管加800ulLB液體培養基,37℃培養1h(150r/min)
5)取適當體積(100ul)的復蘇細胞,涂布在選擇性培養基上,正置30min
6)倒置平皿37℃,12~16h,出現菌落
3.3質粒提取步驟
1)取1~4ml在LB培養基中培養過夜的菌液,12000轉離心1min,棄上清
2)加250ul溶液Ⅰ/RNaseA(溶液Ⅰ為細胞懸浮液)混合液,漩渦劇烈振蕩直至菌體完全重新懸浮,室溫靜置1-2min。
3)加入250ul溶液Ⅱ(細胞裂解液),輕柔的反復顛倒混勻5-6次。室溫放置1-2min,使菌體充分裂解,直至形成澄清的裂解溶液。
4)加入350ul溶液Ⅲ(中和液),立刻輕柔地反復顛倒混勻5-6次,此時會出現白色絮狀沉淀。
5)12000室溫離心10min,收集上清。
6)將上清置于DNA純化柱中,靜置1-2min。
7)12000轉離心1min,棄濾液。
8)加入500ul溶液PB(洗滌液)12000轉離心1min,棄濾液,目的是將硅膠膜上吸附的蛋白、鹽等雜質洗脫,以獲得高質量質粒DNA。
9)加入500ul溶液W(去鹽液),12000轉離心1min,棄濾液,重復一次。
10)12000轉離心3min,以徹底去除純化柱中殘留的液體。
11)將DNA純化柱置于新的離心管中,懸浮滴加50-100ul溶液Eluent(為無菌的雙蒸水,PH為8.0-8.5),室溫放置2min。
12)12000轉離心1min,此時管底即為高純度的質粒DNA,質粒于-20℃保存。
質粒提取步驟:吸取液體培養基于1.5ml離心管中12000轉離心1min,棄上清,吸取培養基重復離心棄上清離心,留取少量菌液作為菌種保存,可直接置于-20℃——加250ulBufferS1懸浮細菌,懸浮均勻——加250ulBufferS2溫和充分的上下翻轉4-6次混合均勻,使菌體裂解——加350ulBufferS3溫和上下翻轉12000離心10min——取上清液轉移到專用的制備管(2ml)12000轉離心1min,棄濾液——加500ulBufferW112000轉離心1min,棄濾液——加500ulBufferW212000轉離心1min,棄濾液,重復一遍——將制備管置回2ml離心管12000轉離心1min——將制備管移入新的1.5ml離心管中,加60~80ulEluent或離子水,室溫1min12000轉離心1min——移去制備管,將有質粒的離心管于4℃或是-20℃保存
4、質粒DNA和其他包裝質粒共轉染293T細胞產生病毒(即病毒包裝)
4.1名詞解釋
4.1.1293T細胞是由293細胞派生, 表達SV40大T抗原的人腎上皮細胞系, 被廣泛應用于瞬時轉染以過表達各種目標蛋白, 或是用以包裝病毒。
4.1.2脂質體:某些細胞質中的天然脂質小體,可作為生物膜,用于捕獲外源性物質后更有效地運送到靶細胞,經同細胞融合而釋放。
4.2共轉染的操作步驟
天:用無抗生素DMEM+10%FBS鋪板293FT細胞,2ml/孔。確保第二天細胞密度達到80%-90%融合度
第二天:
1. 500ul 無血清培養基稀釋2ug 表達質粒+1.5ug psPAX2+1.5ug pMD2.G
2. 500ul 無血清培養基稀釋15ul 脂質體2000
3. 5min后,將DNA溶液和脂質體溶液混合,室溫靜止20min
4. 從6孔板中吸出1ml無血清培養基,然后滴加入1ml質粒和脂質體混合物。
5. 6-10h后,移除含有DNA-脂質體復合物的培養基,代之以正常培養液DMED+10%FB(從此刻開始算時間)。
第三天:
1.轉染24h后,熒光顯微鏡下觀察,轉染效率應達到70%以上
第四天:
1.轉染后48和72h分別收獲含病毒的上清。
2.3000 rpm 離心20min,0.45um濾膜過濾,去除細胞沉淀。
3.12000轉離心濃縮細胞、分裝-80°C貯存。
4.滴度測定目的基因檢定,并出具檢測報告。
4.3病毒包裝的原理
質粒DNA為能轉錄出慢病毒遺傳物質(RNA),但不能翻譯出慢病毒的外殼及蛋白成分的載體質粒,其同時連有目的基因和報告基因,psPAX2為能表達慢病毒外殼的質粒,其表達產物可通過粘附機制更易穿過細胞膜, pMD2.G為慢病毒的膜蛋白質粒,通過 lipofectamine2000進行三質粒共轉到靶細胞基因組中,宿主基因組在表達時,隨宿主基因轉錄出的目的基因RNA與psPAX2、pMD2.G基因翻譯出的蛋白組裝為慢病毒。
在上述程序中提及的“第四天”收集病毒。在第五天再用該病毒感染靶細胞,病毒進入細胞后,其遺傳物質RNA反轉錄出DNA,該基因再整合到靶細胞的基因組中,完成轉染過程,因為質粒DNA只能轉錄出病毒RNA和表達目的基因卻不能表達出病毒的外殼和膜蛋白成分,因此其不能像普通的病毒一樣在宿主細胞能反復增殖,故對宿主細胞是無害的并且的將目的基因轉然到靶細胞基因組中。
5、慢病毒感染細胞
5.1流程圖
5.2感染步驟
1)鋪板:將對數生長期的細胞消化重懸后,按1*105/L密度接種于12孔板,生長過夜
2)感染:將70-80%鋪滿12孔板中的培養液吸除,換新鮮的培養液,同時加入PBS濃度梯度稀釋的病毒液,混合均勻后即可放入孵箱培養。
3) 24h左右可換液,48小時即可看熒光,具體根據細胞狀態來看。
5.3熒光顯微鏡的操作流程
打開熒光器(30min內不能關閉,否則影響顯微鏡壽命),細胞培養板置于載物臺,調節物鏡和光圈,先用自然光觀察視野內細胞,再關閉光,開啟熒光通道,觀察熒光強度,判定感染率。圖片取樣前可以調節曝光時間,增益值和彩色度使熒光照片最。(針對leica)
5.4注意事項內容
1.病毒濃度要適宜,太少的話細胞被感染的也少,但是病毒濃度太大,對細胞有傷害。
2.感染病毒時培養基量少,以保證病毒的濃度,在培養10h左右可根據培養基顏色加培養基。
3.在不明確細胞感染復數情況下,可進行濃度梯度感染,計算細胞感染復數。
4.在加病毒后一般24h左右可換液,48小時即可看熒光,具體時間根據細胞狀態來看。
6、感染后的細胞檢測方法
6.1熒光初步檢測
若有熒光,則表示病毒感染成功,但并不能確定目的基因是否整合到細胞中,待進一步檢測,熒光有強弱之分,與病毒加入的量有關。
6.2RNA的提取及RT-PCR檢測
6.2.1原理
因為真核細胞DNA含有很多非編碼區,真核生物的DNA轉錄成為RNA之后,經過剪切和拼接,去掉這些非編碼區,才能形成真正的mRNA,,是否表達真核生物的基因并表達相應的蛋白,只能通過提取其mRNA并RT-PCR這條途徑來測定
6.2.2RNA提取步驟
加1mlTrizol,吹打后移至1.5ml無菌的離心管中;加100ul氯仿劇烈振蕩30s混勻,12000轉15min,可看到明顯分層;取上層透明液體至新的1.5ml離心管中,加等體積的異丙醇,混勻靜置10min,12000轉離心10min,棄上清,加1ml70%乙醇,12000轉,離心10min,棄上清,風干剩余液體,最后加DEPC-水溶解RNA,電泳,粗步判定RNA純度。
6.2.3RT-PCR步驟:
RT是一個逆轉錄的過程,用前提取好的總RNA,在加入引物,模版和酶,并在PCR儀的溫度設置下,RNA可逆轉錄為cDNA。
PCR是cDNA在模版,引物,酶的作用下進行復制成雙鏈DNA。(具體步驟省略)
6.3蛋白提取及Western檢測
western-Bloting:蛋白免疫印跡(Western blotting 或 Immunoblotting)一般由凝膠電泳、樣品的印跡和免疫學檢測三個部分組成。步是做 SDS 聚丙烯酰胺凝膠電泳,使待測樣品中的蛋白質按分子量大小在凝膠中分成帶。 第二步把凝膠中已分成條帶的蛋白質轉移到一種固相支持物上,用得最多的材料是硝酸纖維素膜(NC 膜)和 PVDF 膜, 蛋白轉移的方法多用電泳轉移 (轉移電泳) ,它又有半干法和濕法之分,現在大多用濕法。第三步是用特異性的抗體檢測出已經印跡在膜上的所要研究的相應抗原。免疫檢測的方法可以是直接的和間接的。現在多用間接免疫酶標的方法,在用特異性的抗體雜交結合后,再用酶標的第二抗體(堿性磷酸酶(AP)或辣根過氧化物酶(HRP)標記的抗抗體的抗體)雜交結合,再加酶的底物顯色或者通過膜上的顏色或 X 光底片上暴光的條帶來顯示抗原的存在。該技術被廣泛應用于蛋白表達水平的檢測中。